E. Visentin1; G. Niero1*; F. Benetti2; C. O’Donnell3 y M. DeMarchi1
Departamento de Agronomía, Alimentos, Recursos Naturales, Animales y Ambiente – Universidad de Padua. Legnaro, Italia.
2 Centro Europeo para el Impacto Sustentable de la Nanotecnología, EcamRicert S.R.L. Padua, Italia.
3 Escuela de Biosistemas e Ingeniería de Alimentos – Colegio Universitario Dublin. Belfield, Irlanda. *g.niero@unipd.it
La presencia de microplásticos en los alimentos está suscitando una creciente preocupación debido a sus posibles riesgos para la salud. Si bien numerosos estudios han investigado los microplásticos en el agua y en mariscos, la información disponible sobre los productos lácteos es limitada. Este estudio caracteriza cualitativa y cuantitativamente los microplásticos en la leche, el queso fresco y el queso curado, evaluando los niveles de concentración y la composición polimérica mediante el análisis de 28 muestras de lácteos mediante microespectroscopía infrarroja por transformada de Fourier en modo de reflectancia total atenuada. El poli(tereftalato de etileno) fue el más frecuente, seguido del polietileno y el polipropileno. La mayoría de los microplásticos fueron menores de 150 µm, siendo los de 51-100 µm los más comunes (33,8%). Predominaron los fragmentos irregulares (77,4%) y las partículas grises (68,4%). El queso curado presentó la mayor concentración de microplásticos (1857 MP/kg), seguido del queso fresco (1280 MP/kg) y la leche (350,0 MP/kg). Los resultados confirman la contaminación generalizada por microplásticos en los productos lácteos y resaltan la importancia de realizar más investigaciones sobre las vías de contaminación y las estrategias para reducir la exposición a microplásticos en la cadena láctea.
La presencia de microplásticos (MP) en el medio ambiente se ha convertido en una preocupación creciente debido a su amplia distribución, persistencia y posibles efectos adversos para la salud humana. Los microplásticos se definen como fragmentos de plástico cuyo tamaño oscila entre 0,1 µm y 5000 µm1,2. Se han detectado microplásticos en diversos entornos naturales, como océanos3, aguas continentales4,5, sedimentos6,7 y biota8,9. La acumulación de MP en entornos naturales plantea una preocupación urgente sobre sus impactos a largo plazo10. Debido a su pequeño tamaño, los MP pueden acumularse a través de diferentes niveles tróficos e ingresar a la cadena alimentaria, con posibles impactos tanto en los sistemas ecológicos como en la salud humana11.
La vía alimentaria es la principal vía por la que los MP ingresan al cuerpo humano12–14. De hecho, se ha detectado MP en diversas categorías de alimentos, como agua potable15-17, productos de pescado y mariscos18,19, miel20,21, sal de mesa22-24, cerveza25-27 y bebidas28. La ingestión de MP a través de alimentos contaminados plantea importantes interrogantes sobre su biodisponibilidad, acumulación y posibles riesgos para la salud, especialmente desde la perspectiva de la exposición a largo plazo29.
Los productos lácteos han recibido poca atención en cuanto a la caracterización de su posible contenido de MP. Productos como la leche en polvo, la leche líquida, el queso y el yogur pueden estar contaminados con MP en diversas etapas de la cadena de suministro30,31. La contaminación puede ocurrir en la granja, a través de forrajes contaminados32, equipos de ordeño o ropa20. La contaminación también puede ocurrir en la planta, durante el procesamiento, a través de la ropa y el equipo de protección, como redecillas para el cabello, batas de laboratorio desechables y guantes20,33. Además, la contaminación también puede provenir de aditivos alimentarios que contienen residuos de MP34, así como de la maquinaria de procesamiento, el transporte y el almacenamiento35. Dada la complejidad del sector lácteo y el amplio uso de materiales plásticos a lo largo de toda la cadena de producción, comprender las vías de entrada de MP en los productos lácteos es crucial para garantizar la seguridad alimentaria y evaluar los posibles riesgos para la salud30.
Los estudios existentes sobre MP se han centrado en la leche materna36,37, la leche en polvo33,38,39, la leche cruda33,40 y la leche de consumo envasada20,33,41–43, probablemente debido a su detección relativamente sencilla en cuanto a procedimientos analíticos, con especial atención a los pasos de digestión y filtración necesarios para las muestras44,45. Sin embargo, sólo un número limitado de estudios ha investigado la contaminación por MP en productos lácteos. Rbaibi Zipak46 evaluó la presencia de MP en yogur durante cada paso de producción. De manera similar, Buyukunal47 investigó la presencia de MP en la producción de bebidas lácteas, detectándolo en todas las muestras examinadas. Además, Banica48 analizó productos lácteos con alto contenido de grasa, incluyendo muestras de mantequilla y crema agria, y reportó una contaminación significativa. La presencia de MP resalta la necesidad de estudios exhaustivos para evaluar los niveles de contaminación y los posibles riesgos para la salud asociados con la ingestión de MP a través de diversos productos lácteos. Esta brecha de investigación específica resalta la necesidad de una mayor investigación sobre la contaminación de MP en productos lácteos. Por lo tanto, este estudio tiene como objetivo (i) caracterizar cualitativa y cuantitativamente la contaminación por MP en leche, queso fresco y queso madurado, y (ii) evaluar las diferencias en niveles de contaminación entre estos diferentes productos.
RESULTADOS Y DISCUSIÓN
Caracterización de las MP en productos lácteos: tamaño, forma y color.
En la Tabla 1 se presentan las estadísticas descriptivas de los tamaños de los MP detectados en productos lácteos. Los tamaños variaron desde un mínimo de 24,0 µm hasta un máximo de 4817 µm, con un tamaño promedio general de 243,7 µm. Entre los polímeros, el poliacrilato presentó el mayor tamaño promedio (1048 µm), mientras que el fluoruro de polivinilideno y el etilen-acetato de vinilo presentaron los menores tamaños (32,0 µm y 37,5 µm, respectivamente). El poli(tereftalato de etileno), el polipropileno y el polietileno, como MP detectados con mayor frecuencia, presentaron tamaños promedio de 775,8, 114,4 y 109,0 µm, respectivamente, con coeficientes de variación relativamente altos (112,5, 127,8 y 55,2%, respectivamente). Como se muestra en la Figura 1A, el 33,8% de los MP identificados tenían tamaños comprendidos entre 51 µm y 100 µm, seguidos por MP en el rango de 3 µm a 50 µm (19,9%), y por MP en el rango de 101 µm a 150 µm (19,6%). Los fragmentos de MP más grandes, con tamaños de entre 201 µm y 250 µm y de entre 251 µm y 300 µm, fueron menos frecuentes, representando el 3,76% y el 2,26% del total, respectivamente.
El predominio de MP pequeños concuerda con estudios previos que informaron una distribución de tamaño similar, con la mayoría de las partículas midiendo menos de 150 µm46,47. En un estudio sobre la contaminación por MP durante el proceso de producción de yogur, Rbaibi Zipak46 informó que el 43,3% de los MP detectados tenían tamaños entre 1 µm y 150 µm. Buyukunal47 analizó la contaminación por MP durante la producción de bebidas lácteas e informó que el 37,4% de los MP detectados también se encontraban en el rango de 1 a 150 µm. La similitud entre nuestros resultados y los reportados para yogur y bebidas lácteas sugiere que los mecanismos de contaminación en los productos lácteos son consistentes, incluso en diferentes procesos de producción. El predominio de MP por debajo de 150 µm sugiere contaminación proveniente de equipos de procesamiento, degradación de envases plásticos o la deposición de partículas en suspensión durante la producción49.
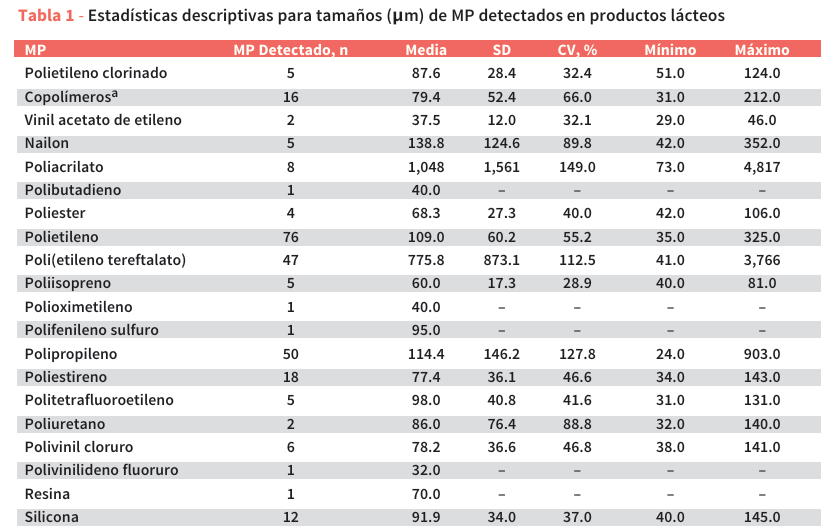
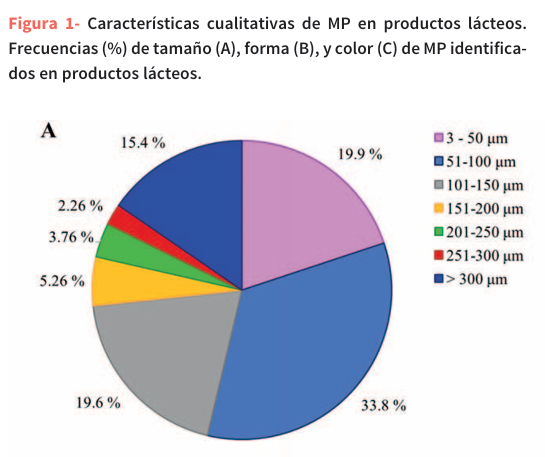
Los datos sobre las formas de las partículas de materia prima detectadas se presentan en la Tabla 2 y la Figura 1B. Se encontraron microesferas exclusivamente dentro de la clase de copolímeros, representando el 0,38% de la partícula de materia prima total (Figura 1B). Se observaron fibras de poli(tereftalato de etileno) (89,4%), poliacrilato (75,0%), polipropileno (16,0%) y polietileno (3,95%) (Tabla 2), que en conjunto representaron el 22,2% de las partículas de MP detectadas (Figura 1B). Estos hallazgos apunta a los textiles sintéticos como una posible fuente de contaminación, posiblemente introducida a través de sistemas de filtración, ropa de protección (como batas de laboratorio, guantes o redecillas para el cabello en entornos de laboratorio o procesamiento de alimentos), restos de materiales sintéticos o fibras en suspensión que se depositan durante el procesamiento de las muestras50. Las formas irregulares predominaron en la mayoría de los polímeros (77,4% del total de MP; Fig. 1B). La alta incidencia de fragmentos irregulares probablemente se deba a la degradación mecánica de los materiales plásticos, posiblemente originada por el embalaje, los equipos de procesamiento o el desgaste causado por la fricción entre los componentes de la máquina y las superficies durante el proceso de producción50. Estos resultados coinciden con los reportados por Buyukunal47, quien también encontró que los fragmentos y las fibras eran las formas predominantes de MP. Sin embargo, su estudio en bebidas lácteas reveló una proporción diferente en cuanto a las formas, siendo las fibras la morfología de MP más abundante (49,8%), seguida de los fragmentos (14,7%) y las esferas (12,4%).
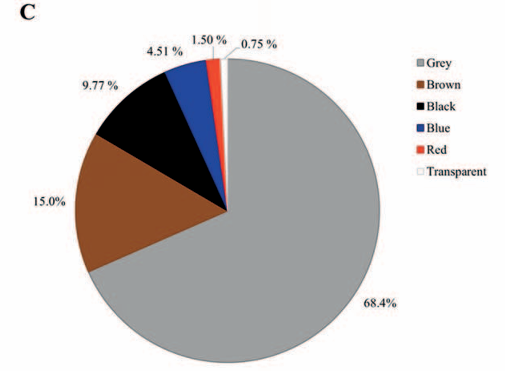
Las frecuencias del color de MP detectados en los productos lácteos también se muestran en la Tabla 2. El MP gris se observó predominantemente en polietileno (84,2%), poliestireno (83,3%), cloruro de polivinilo (83,3%) y polipropileno (82,0%). Se detectaron MP marrones y negros en proporciones menores, encontrándose en 13 y 11 de los 20 polímeros identificados, respectivamente. El MP transparente se encontró exclusivamente en el poli(tereftalato de etileno) (4,26%), lo cual puede atribuirse a componentes específicos del envase. Como se muestra en la Figura 1C, aproximadamente el 93% de los MP identificados en este estudio estaban pigmentados, siendo el gris (68,4%), el marrón (15,0%) y el negro (9,77%) los colores más prevalentes. Sin embargo, Buyukunal47 informó una distribución de colores diferente, siendo los más abundantes el azul (19,8%), el rojo (17,9%) y el transparente (15,0%), seguidos del negro (11,2%). Además, es importante considerar que se pueden añadir diversos pigmentos de color a las mezclas de polímeros durante el proceso de producción. Por lo tanto, los colores observados al microscopio pueden deberse a los pigmentos y aditivos utilizados en la fabricación de envases de plástico46. Por esta razón, la confirmación mediante microespectroscopía infrarroja por transformada de Fourier es esencial para una identificación concluyente. El predominio de MP gris observado en nuestro estudio respalda la hipótesis de que las principales fuentes de contaminación en los productos lácteos están relacionadas con los plásticos y materiales de envasado en contacto con alimentos. El MP gris se asocia comúnmente con componentes plásticos industriales utilizados en el envasado de alimentos, como películas, revestimientos y cierres, que a menudo contienen pigmentos neutros30. Su presencia puede deberse a la abrasión mecánica, el envejecimiento o la degradación de estos materiales durante el procesamiento, la manipulación o el almacenamiento, más que a la contaminación ambiental35,41.
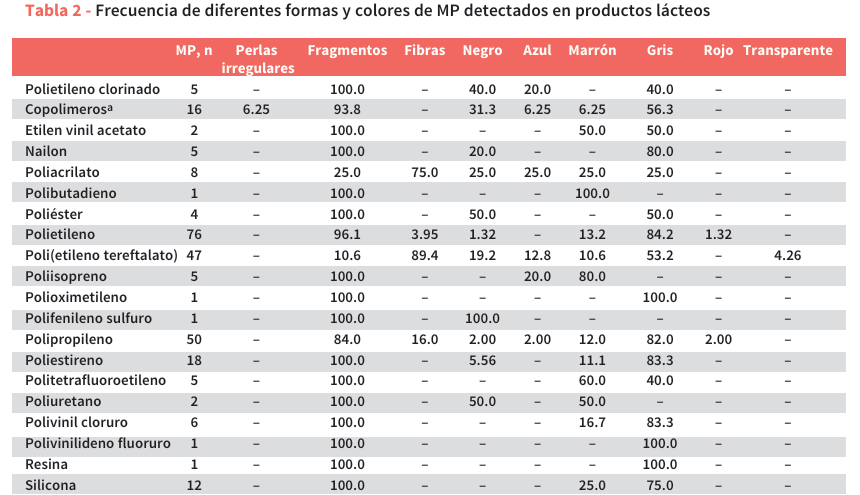
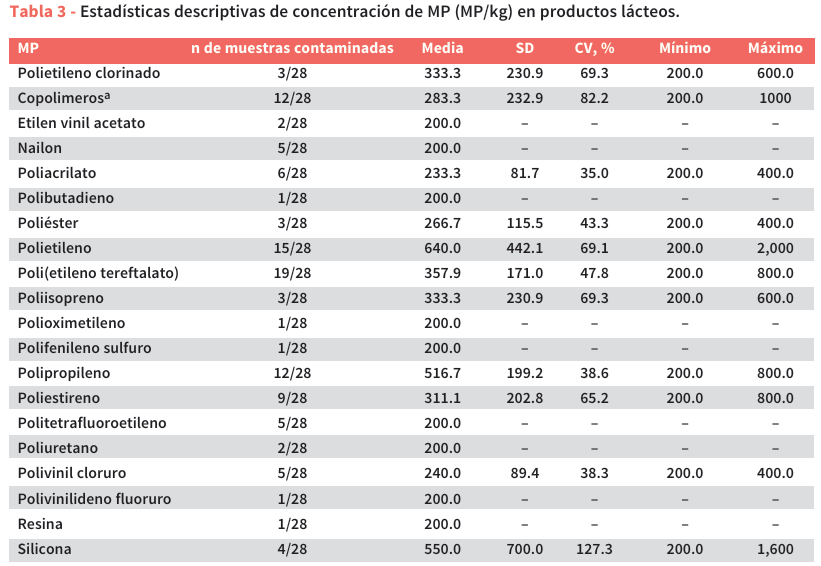
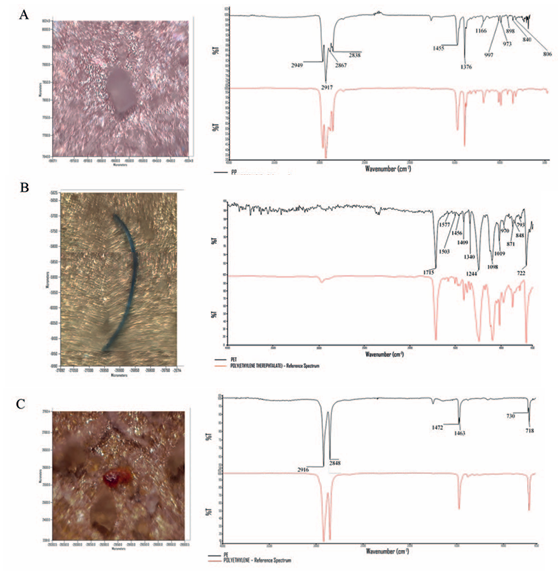
Los polímeros se consideraron correctamente determinados cuando la coincidencia fue superior al 80%. Los picos más significativos se enumeran en la Tabla 4, junto con los modos vibracionales asociados. Se almacenaron electrónicamente imágenes de alta resolución de partículas de polímero (MP) utilizando el software Spectrum 10. El tamaño, el color y la forma de cada partícula de MP se determinaron mediante el software ImageJ (ImageJ 2022). El tamaño se midió en la longitud máxima de cada partícula de MP.
Las estadísticas descriptivas de la concentración de MP en productos lácteos se presentan en la Tabla 3. Se analizaron 28 muestras de productos lácteos, detectándose MP en 26 de ellas. En total, se identificaron 266 partículas plásticas pertenecientes a 20 clases de polímeros diferentes. El poli(tereftalato de etileno) se encontró en 19 muestras, siendo el polímero más frecuentemente identificado, seguido del polietileno (presente en 15 muestras), el polipropileno (presente en 12 muestras) y los copolímeros (presentes en 12 muestras). El polietileno presentó la concentración promedio más alta (640,0 MP/kg), seguido del polipropileno (516,7 MP/kg) y el poli(tereftalato de etileno) (357,9 MP/kg). Cabe destacar que algunos polímeros se detectaron en casos aislados. Estos incluían polibutadieno, polioximetileno, sulfuro de polifenileno, fluoruro de polivinilideno y resina, que se encontraron en muestras individuales. La silicona presentó el mayor coeficiente de variación (127,3%), lo que sugiere una variabilidad significativa en las muestras analizadas. Por el contrario, el poliacrilato, el cloruro de polivinilo y el polipropileno mostraron los coeficientes de variación más bajos (35,0%, 38,3% y 38,6%, respectivamente), lo que indica una distribución más homogénea entre las muestras contaminadas.
Se han observado concentraciones de MP similares en otros estudios. Por ejemplo, en un estudio sobre MP en bebidas lácteas turcas, Buyukunal47 informó concentraciones que oscilaban entre 3 y 43 MP/100 ml, detectándose los niveles de contaminación más altos en las muestras recolectadas después de los pasos de homogeneización y pasteurización. Los mismos autores reportaron una concentración promedio de 19 MP/100 ml en leche cruda, lo que sugiere que la contaminación en la matriz cruda juega un papel crucial en la determinación del contenido total de MP en el producto final. Rbaibi Zipak et al.46, en su investigación sobre la contaminación por MP a lo largo del proceso de producción de yogur, reportaron concentraciones que oscilaban entre 2 y 58 MP/100 mL, con la menor contaminación encontrada en las primeras etapas del procesamiento (en el tanque de leche a granel) y la mayor contaminación en las etapas finales (durante el proceso de llenado de los vasos de yogur). Da Costa Filho et al.33 identificaron concentraciones de MP en diferentes tipos de leche, incluyendo leche cruda, leche líquida entera y desnatada, y productos lácteos en polvo, que oscilaban entre 204 y 1004 MP/100 ml, siendo el polietileno y el polipropileno los polímeros predominantes, lo cual concuerda con nuestros hallazgos.
Por el contrario, Kutralam-Muniasamy41 y Basaran43 encontraron concentraciones de MP considerablemente más bajas en leche líquida comercial de diferentes marcas, que oscilaron entre 1 y 16 MP/L y entre 3 y 11 MP/L, respectivamente. La gran variabilidad en los niveles de MP detectados en los diferentes estudios puede atribuirse a las diferencias en las características de las muestras -como el tipo de pro ducto lácteo, el contenido de grasa y el origen-, así como a la etapa específica del proceso de producción láctea muestreado, junto con los protocolos de medición de MP empleados. Las fuentes comunes de MP incluyen envases de plástico, materiales en contacto con alimentos utilizados durante el procesamiento y fibras sintéticas de la ropa de los operarios30,31.
Se han observado niveles similares de contaminación en otros productos alimenticios, especialmente en la carne. Por ejemplo, Visentin51 identificó un total de 898 partículas de plástico en hamburguesas de carne de res, pertenecientes a 18 clases de polímeros diferentes. La detección de diferentes clases de polímeros, como el policarbonato, el polietileno y el polipropileno, destaca la alta variabilidad de los contaminantes plásticos en los productos cárnicos, lo cual concuerda con la diversidad de polímeros observada en el presente estudio. Kedzierski et al.52 demostraron que las partículas de plástico de las bandejas de poliestireno utilizadas en el envasado comercial de carne de pollo se adhirieron a la superficie de la carne incluso después del enjuague, lo que pone de manifiesto un riesgo potencial para los consumidores. Las vías de contaminación identificadas a lo largo de la cadena de suministro de carne también podrían aplicarse al sector lácteo, siendo los equipos de envasado y procesamiento posibles fuentes comunes de contaminación por MP en diferentes matrices alimentarias.
Variabilidad de la contaminación por MP en productos lácteos
Los puntos de datos y las medias de mínimos cuadrados (LSMs) de la concentración total de MP detectada en muestras de leche, queso fresco y queso madurado se presentan en la Figura 2. El análisis de varianza destacó que el queso madurado presentó la mayor concentración de MP (1857 MP/kg), seguido del queso fresco (1280 MP/kg) y la leche (350.0 MP/kg; P<0.05). La literatura actual proporciona poca información sobre la variabilidad de la contaminación por MP en productos lácteos, particularmente en relación con las diferentes etapas de procesamiento y los diferentes tipos de queso. Kutralam-Muniasamy et al. analizaron 23 muestras de leche de diversas marcas en México, incluyendo leche entera, leche sin lactosa y leche baja en grasa. Encontraron que los MP estaban presentes en todas las muestras analizadas, y que la leche procesada (como las variedades sin lactosa y baja en grasa) presentó mayores concentraciones de MP en comparación con la leche entera. En un estudio sobre la contaminación por MP en productos lácteos, Da Costa Filho33 analizó ocho muestras: dos de leche cruda, tres de leche entera, una de leche desnatada y dos de leche desnatada en polvo. Descubrieron que la leche en polvo contenía la mayor concentración de MP, con contaminación relacionada con plásticos ambientales omnipresentes, materiales de envasado y procesamiento (en particular, el uso de membranas poliméricas durante la filtración y el secado). Badwanache et al.53 analizaron 21 muestras de leche: siete de leche cruda transferidas directamente de la granja al laboratorio en contenedores de acero, siete de diferentes empresas lácteas envasadas en bolsas de polietileno y siete de leche de marca comercial en botellas de polietileno. Sus hallazgos revelaron que las muestras de leche de marca comercial presentaron la mayor concentración de MP, atribuible principalmente al envase de plástico. Por el contrario, la leche recolectada directamente de granjas o lecherías mostró niveles más bajos de contaminación, lo que confirma la contribución del envasado al aumento de la contaminación por MP.
En el presente estudio, se encontró que el queso presenta niveles más altos de MP en comparación con la leche. Esto probablemente se deba al proceso de elaboración del queso, ya que este procedimiento elimina el suero, reduciendo así la masa total y concentrando los componentes sólidos, incluidos los fragmentos de MP41. En otras palabras, es probable que los MP no se eliminen preferentemente a través de la fracción de suero, lo que resulta en su concentración en la cuajada.
Este fenómeno es particularmente evidente en el queso madurado, donde la pérdida de humedad durante el envejecimiento y los pasos adicionales del procesamiento pueden contribuir aún más a la acumulación de MP. Según el conocimiento de los autores, ningún estudio ha investigado específicamente la contaminación por MP en el queso. Sin embargo, Banica48 investigó la presencia de MP en productos lácteos ricos en grasa, incluyendo 11 muestras de mantequilla de diversas marcas (tanto convencionales como orgánicas), así como siete muestras de crema agria de diferentes productores. Los hallazgos indicaron que la mantequilla convencional presentó la mayor concentración de MP (7875 MP/kg), seguida de la crema agria (5600 MP/kg) y la mantequilla orgánica (2500 MP/kg). Estos hallazgos coinciden con los resultados del presente estudio, en el que se observó que los productos lácteos sometidos a un procesamiento más intensivo y con mayor contenido de grasa, como el queso, presentaban mayores concentraciones de MP que los productos bajos en grasa menos procesados, como la leche líquida. Esto respalda la hipótesis de que el procesamiento intensivo y el alto contenido de grasa pueden facilitar la acumulación de MP. Además, la detección constante de MP en diferentes productos sugiere que múltiples fuentes de contaminación, introducidas en diversas etapas de la cadena de producción, probablemente contribuyan a las diferencias en las concentraciones de MP observadas entre los productos lácteos.
La elaboración del queso implica múltiples etapas, como el corte de la cuajada, el moldeado, el prensado y la maduración. Todas ellas pueden aumentar la exposición a MP debido al contacto prolongado con superficies de procesamiento, equipos y materiales en contacto con alimentos54. Por ejemplo, los moldes de plástico, los recipientes de almacenamiento y las películas de embalaje que se utilizan durante la producción y maduración del queso podrían representar posibles fuentes de contaminación. El tiempo prolongado de maduración del queso curado podría contribuir aún más a la acumulación de MP, ya que el almacenamiento prolongado en materiales plásticos puede provocar la liberación gradual de partículas. Las diferencias en los niveles de contaminación entre las tres categorías de productos analizadas en este estudio (leche líquida, queso fresco y queso curado) sugieren que los quesos curados son más susceptibles a la contaminación por MP, probablemente debido a la complejidad de sus procesos de producción y a los materiales utilizados en sus cadenas de suministro.
Se puede concluir que la contaminación por MP varía considerablemente entre los diferentes productos lácteos. Las 28 muestras analizadas, incluyendo leche líquida, queso fresco y queso curado, mostraron una amplia variabilidad de MP en cuanto a tamaño, forma y color. El tamaño de MP detectado osciló entre 24,0 y 4817 µm, con un promedio de 243,7 µm. Los fragmentos irregulares fueron la morfología predominante (77,4%), y la gran mayoría de los MP estaban pigmentados, siendo el gris (68,4%), el marrón (15,0%) y el negro (9,77%) los colores más frecuentes. Los polímeros detectados con mayor frecuencia fueron el poli(tereftalato de etileno), el polietileno y el polipropileno, presentes en 19, 15 y 12 muestras, respectivamente. Se observaron diferencias significativas en las concentraciones de MP en los distintos productos lácteos, siendo el queso curado el que presentó los niveles más altos de MP (1857 MP/kg), seguido del queso fresco (1280 MP/kg) y la leche (350,0 MP/kg). Estos hallazgos enfatizan la importancia de considerar el tipo específico de producto lácteo al evaluar el grado de contaminación por MP en el sector lácteo. Tanto el proceso de producción como los materiales de envasado utilizados pueden influir en el nivel de contaminación, por lo que se deben desarrollar estrategias de mitigación específicas en consecuencia. Se recomienda realizar investigaciones futuras a nivel de planta, abarcando todas las etapas del proceso de producción, para identificar fuentes específicas de contaminación por MP y respaldar el desarrollo de estrategias de mitigación eficaces.
MÉTODOS
Recolección de muestras
Se adquirieron 28 muestras en grandes superficies, incluyendo cuatro muestras de leche ultrapasteurizada (1 L cada una), diez muestras de queso fresco (500 g cada una, con menos de un mes de maduración) y 14 muestras de queso curado (500 g cada una, con más de 4 meses de maduración). Los nombres comerciales no se divulgan para mantener la objetividad y evitar posibles conflictos de intereses. Tras la compra, las muestras se transportaron al laboratorio del Centro Europeo para el Impacto Sostenible de la Nanotecnología (ECSIN, Padua, Italia), perteneciente a Mérieux Nutri Sciences Company (Chicago, EE. UU.), donde se congelaron a su llegada.
Reactivos y equipo
El pretratamiento de las muestras, que incluyó la fragmentación, la digestión, la microfiltración y la detección de MP, se realizó en una sala blanca específica que cumple con la norma ISO 14644-1:2015 Clase 7 (ISO, 2015). Todas las soluciones se microfiltraron a través de un filtro de membrana de plata (tamaño de poro de 3,0 µm, 25 mm de diámetro; Sterlitech Corporation, Auburn, Estados Unidos). Se generó agua ultrapura (resistividad: 18,3 MΩ/cm a 25 °C) utilizando un sistema Zeneer Power III (Human Corporation, Garak-ro, República de Corea). Las superficies de trabajo se limpiaron a fondo antes y durante los procedimientos experimentales para evitar la contaminación de las muestras. El material de vidrio se lavó en cinco ciclos con agua destilada, seguido de cinco enjuagues con agua ultrapura y se secó en horno antes de su uso.
El entorno del laboratorio se gestionó cuidadosamente para prevenir la contaminación, manteniendo un estricto control de las partículas en suspensión, la temperatura y la humedad. El laboratorio estaba equipado con ambiente controlado con estándar ISO clase 7, lo que garantizaba el uso de filtros para aire particulado de alta eficiencia (HEPA) con el fin de mantener la calidad del aire y una presión positiva para evitar la entrada de contaminantes del exterior. Los operadores usaban batas antiestáticas y evitaban el uso de materiales, como guantes de látex o nitrilo, que pudieran liberar partículas o residuos que pudieran interferir con los análisis de MP. También se evitaron los cubrecabellos para minimizar aún más los riesgos de contaminación. Para proteger el equipo y mantener la pureza de las muestras, todas las herramientas utilizadas durante la preparación se cubrieron con papel de aluminio.
Cuarteado, digestión y microfiltración demuestras
Antes del análisis, las muestras de leche se descongelaron durante la noche a temperatura ambiente y se invirtieron suavemente cinco veces para promover la homogeneización de grasas y sólidos. Se utilizó una alícuota de 100 ml para las fases analíticas posteriores. Los quesos frescos y curados se descongelaron durante la noche y se desempaquetaron. Posteriormente, se realizó un cuarteado para obtener una alícuota representativa del queso. Este procedimiento implicó dividir cada muestra en cuatro partes iguales, descartar dos cuartos y recombinar las porciones restantes. El proceso se repitió cuarteando nuevamente la porción recombinada, hasta alcanzar un peso final de muestra de 10 g. Para eliminar los componentes orgánicos, se empleó un protocolo de digestión basado en los métodos descritos por Dehaut44 y EFSA1, que incluye tanto digestión enzimática como química. Para la digestión enzimática, se añadieron 100 ml de agua ultrapura y 20 ml de solución de tripsina al 5% (Merck KGaA, Darmstadt, Alemania) a 100 ml de leche y 10 g de queso en un matraz de vidrio. La mezcla se agitó a 37°C durante la noche con un agitador Shake’n Bator (EuroClone, Milán, Italia). Para la digestión química, se añadieron 100 ml de solución de hidróxido de potasio (KOH) al 10% a cada muestra. La mezcla se agitó a 60°C durante la noche en el Shake’n Bator. Finalmente, se añadieron 100 ml de solución de ácido etilendiaminotetraacético (EDTA) al 10% y la mezcla se agitó a 60°C durante 2 h en el Shake’n Bator. Tras la digestión, todas las muestras se micro filtraron a través de filtros de membrana de plata (tamaño de poro de 3,0 µm; Sterlitech Corporation, Auburn, Estados Unidos). La separación por densidad de MP en muestras de leche y queso se realizó utilizando una solución sobresaturada de NaCl (MerckKGaA, Darmstadt, Alemania) como solución de flotación, lo que permitió suspender también fragmentos pesados de MP. Este paso se repitió tres veces para mejorar la eficiencia de la separación. Durante la microfiltración, el embudo de filtración se cubrió con papel de aluminio para minimizar la contaminación. Finalmente, la membrana filtrante se secó en un horno a 70°C durante 24 h.
Identificación y cuantificación de partículas de polímero mediante µ-FTIR-ATR
Las membranas filtrantes se analizaron con un espectrómetro FTIR Frontier acoplado a un microscopio Spotlight 400 (PerkinElmer Italia Spa, Milán, Italia). Los polímeros se identificaron mediante microespectroscopia infrarroja por transformada de Fourier, con longitudes de onda de detección espectral en el rango de 4000 cm−1 a 650 cm−1. Cada partícula de MP detectada se sometió a cuatro barridos repetidos de µ-FTIR-ATR, hasta obtener el espectro promedio final. Los espectros de fondo se registraron utilizando aire como medio de referencia. Para minimizar errores, los espectros obtenidos para cada partícula de MP se corrigieron restando los espectros de fondo de aire correspondientes. De esta manera, los espectros se compararon con una biblioteca de referencia utilizando Software Spectrum 10 (PerkinElmer Italia Spa, Milán, Italia) (Figura 3).


Blancos y método de recuperación
Para evaluar la posible contaminación derivada del procedimiento analítico, se prepararon blancos simultáneamente con cada muestra, siguiendo los mismos procedimientos de pretratamiento de muestras (es decir, digestión y microfiltración) y análisis µ-FTIR-ATR. Los blancos se consideraron aceptables si no contenían más de diez fragmentos de MP. Si un blanco superaba este umbral (es decir, ≥11 fragmentos de MP), el análisis de la muestra correspondiente se consideraba inválido y se repetía. El número de contaminantes de MP detectados en los blancos se restaba del total de fragmentos de MP detectados en la muestra correspondiente.
La tasa de recuperación de MP se evaluó añadiendo muestras de agua ultrapura con un estándar comercial de poliestireno (Cospheric LLC, Santa Bárbara, CA). Las muestras enriquecidas se procesaron tras completar los procedimientos de digestión y filtración. Se analizaron diez niveles de adición, desde 22 MP/kg hasta 207 MP/kg de agua. Las tasas de recuperación oscilaron entre el 66% y el 122%, con una recuperación promedio del 84%.
Análisis estadístico
Para cada muestra, se calculó la concentración total de MP (MP/kg) como la suma de las concentraciones de todas las clases de MP. La concentración total de MP se distribuyó normalmente y no se detectaron valores atípicos. Los datos se analizaron posterior mente mediante el software R (v. 4.1.3), según el siguiente modelo lineal descrito en la ecuación (1):

Donde
yi es la variable dependiente (i.e., la concentración total de MP detectada en cada muestra);
µ es el intercepto general del modelo;
dairy product es el efecto fijo del i-ésimo tipo de producto lácteo (tres clases: leche, queso fresco y queso
curado);
e es el error aleatorio.
Se realizaron comparaciones múltiples de LSM mediante el ajuste de Bonferroni, con un umbral de significancia de p ≤ 0,05.
REFERENCIAS
1. Van Cauwenberghe, L. & Janssen, C. R. Microplastics in EFSA Panel on Contaminants in the Food Chain (CONTAM)
Presence of microplastics and nanoplastics in food, with particular focus on seafood. EFSA J. 14, 4501 (2016).
2.German Federal Institute for Risk Assessment (BfR), Department of Food Safety, Unit Effect-based Analytics and Toxicogenomics Unit and Nanotoxicology Junior Research Group, Berlin, Germany, Shopova, S., Sieg, H. & Braeuning, A. Risk assessment and toxicological research on micro-and nanoplastics after oral exposure via food products. EFSA J. 18, e181102 (2020).
3.do Sul, J. A. I. & Costa, M. F. The present and future of microplastic pollution in the marine environment. Environ. Pollut. 185, 352–364 (2014).
4.Imhof, H. K. et al. Pigments and plastic in limnetic ecosystems: a qualitative and quantitative study on microparticles of different size classes. Water Res. 98, 64–74 (2016).
5. Free, C. M. et al. High-levels of microplastic pollution in a large, remote, mountain lake. Mar. Pollut. Bull. 85, 156–163 (2014).
6. Zhang, S. et al. A simple method for the extraction and identification of light density microplastics from soil. Sci. Total Environ. 616, 1056–1065 (2018).
7. Van Cauwenberghe, L., Devriese, L., Galgani, F., Robbens, J. & Janssen, C. R. Microplastics in sediments: a review of techniques, occurrence and effects. Mar. Environ. Res. 111, 5 17 (2015).
8. Van Cauwenberghe, L., Claessens, M., Vandegehuchte, M. B. & Janssen, C. R. Microplastics are taken up by mussels (Mytilus edulis) and lugworms (Arenicola marina) living in natural habitats. Environ. Pollut. 199, 10–17 (2015).
9. bivalves cultured for human consumption. Environ. Pollut. 193, 65–70 (2014).
10. Li, Y., Peng, L., Fu, J., Dai, X. & Wang, G. A microscopic survey on microplastics in beverages: the case of beer, mine
ral water and tea. Analyst 147, 1099–1105 (2022).
11. Kwon, J. H. et al. Microplastics in food: a review on analytical methods and challenges. Int. J. Environ. Res. Public Health 17, 6710 (2020).
12. Rahman, A., Sarkar, A., Yadav, O. P., Achari, G. & Slobodnik, J. Potential human health risks due to environmental exposure to nanoand microplastics and knowledge gaps: a scoping review. Sci. Total Environ. 757, 143872 (2021).
13. Toussaint, B. et al. Review of micro-and nanoplastic contamination in the food chain. Food Addit. Contam. A 36, 639 673 (2019).
14. Jin, M., Wang, X., Ren, T., Wang, J. & Shan, J. Microplastics contamination in food and beverages: direct exposure to humans. J. Food Sci. 86, 2816–2837 (2021).
15. Liu, Q. et al. Microplastics and nanoplastics: emerging contaminants in food. J. Agric. Food Chem. 69, 10450–10468 (2021).
16. Oβmann, B. E. et al. Small-sized microplastics and pigmented particles in bottled mineral water. Water Res. 141, 307–316 (2018).
17. Pivokonsky, M. et al. Occurrence of microplastics in raw and treated drinking water. Sci. Total Environ. 643, 1644 1651 (2018).
18. Zhang, Q. et al. A review of microplastics in table salt, drinking water, and air: direct human exposure. Environ. Sci. Technol. 54, 3740–3751(2020).
19 Akhbarizadeh, R. et al. Abundance, composition, and potential intake of microplastics in canned fish. Mar. Pollut. Bull. 160, 111633 (2020).
20. Diaz-Basantes, M. F., Nacimba-Aguirre, D., Conesa, J. A. & Fullana, A. Presence of microplastics in commercial canned tuna. Food Chem. 385, 132721 (2022).
21. Diaz-Basantes, M. F., Conesa, J. A. & Fullana, A. Microplastics in honey, beer, milk and refreshments in Ecuador as emerging contaminants. Sustainability 12, 5514 (2020).
22. Mühlschlegel, P., Hauk, A., Walter, U. & Sieber, R. Lack of evidence for microplastic contamination in honey. Food Addit. Contam. Part A 34, 1982–1989 (2017).
23. Yang, D. et al. Microplastic pollution in table salts from China. Environ. Sci. Technol. 49, 13622–13627 (2015).
24. Iniguez, M. E., Conesa, J. A. & Fullana, A. Microplastics in Spanish table salt. Sci. Rep. 7, 8620 (2017).
25. Karami, A. et al. The presence of microplastics in commercial salts from different countries. Sci. Rep. 7, 46173 (2017).
26. Lachenmeier, D. W. & Kuballa, T. Microplastic identification in German Beer. An artefact of laboratory contamination?. Dtsch. Lebensm. Rundsch. 111, 437–440 (2015).
27. Kosuth, M., Mason, S. A. & Wattenberg, E. V. Anthropogenic contamination of tap water, beer, and sea salt. PLoS One 13, e0194970 (2018).
28. Shruti, V. C., Pérez-Guevara, F., Elizalde-Martínez, I. & Kutralam-Muniasamy, G. First study of its kind on the microplastic contamination of soft drinks, cold tea and energy drinks—future research and environmental considerations. Sci. Total Environ. 726, 138580 (2020).
29. Eze, C. G., Nwankwo,C. E., Dey, S., Sundaramurthy, S. & Okeke, E. S. Food chain microplastics contamination and impact on human health: a review. Environ. Chem. Lett. 22, 1889–1927 (2024).
30. Kaseke, T., Lujic, T. & Cirkovic Velickovic, T. Nano-and microplastics migration from plastic food packaging into dairy products: impact on nutrient digestion, absorption, and metabolism. Foods 12, 3043 (2023).
31. Adjama, I., Dave, H., Balarabe, B. Y., Masiyambiri, V. & Marycleopha, M. Microplastics in dairy products and human breast milk: Contamination status and greenness analysis of available analytical methods. J. Hazard. Mater. Lett. 5, 100120 (2024).
32. Sobhani, Z. et al. Microplastics generated when opening plastic packaging. Sci. Rep. 10, 4841 (2020).
33. Da Costa Filho, P. A. et al. Detection and characterization of small sized microplastics (≥5 µm) in milk products. Sci. Rep. 11, 24046 (2021).
34. Al Mamun, A., Prasetya, T. A. E., Dewi, I. R. & Ahmad, M. Microplastics in human food chains: food becoming a threat
to health safety. Sci. Total Environ. 858, 159834 (2023).
35. Kataria, N. et al. Occurrence, transport, and toxicity of microplastics in tropical food chains: perspectives view and way forward. Environ. Geochem. Health 46, 98 (2024).
36. Ragusa, A. et al. Raman microspectroscopy detection and characterisation of microplastics in human breastmilk. Polymers 14, 2700 (2022).
37. Liu, S. et al. Detection of various microplastics in placentas, meconium, infant feces, breastmilk and infant formula: A pilot prospective study. Sci. Total Environ. 854, 158699 (2023).
38. Zhang, Q. et al. Microplastics in infant milk powder. Environ. Pollut. 323, 121225 (2023).
39. Visentin, E. et al. Characterization of microplastics in skim-milk powders. J. Dairy Sci. 107, 5393–5401 (2024).
40. Rbaibi Zipak, S., Muratoglu, K. & Buyukunal, S.K. Microplastics in raw milk samples from the Marmara region in
Turkey. J. Consum. Prot. Food Saf. 19, 175–186 (2024).
41. Kutralam-Muniasamy, G., Pérez-Guevara, F., Elizalde Martínez, I. & Shruti, V. C. Branded milks—Are they immune from microplastics contamination?. Sci. Total Environ. 714, 136823 (2020).
42. Kiruba, R. et al. Identification of microplastics as emerging contaminant in branded milk of Tamil Nadu State, India. Asian J. Biol. Life Sci. 11, 181 (2022).
43. Basaran, B., Özçifçi, Z., Akcay, H. T. & Aytan, Ü Microplastics in branded milk: dietary exposure and risk assessment. J. Food Compos. Anal. 123, 105611 (2023).
44. Dehaut, A. et al. Microplastics in seafood: benchmark protocol for their extraction and characterization. Environ. Pollut. 215, 223–233 (2016).
45. Guo, X., Lin, H., Xu, S. & He, L. Recent advances in spectroscopic techniques for the analysis of microplastics in food. J. Agric. Food Chem. 70, 1410–1422 (2022).
46. Rbaibi Zipak, S., Muratoglu, K. & Buyukunal, S. K. Evaluation of microplastic presence in yogurt production process. Kafkas Univ. Vet. Fak. Derg. 28, 633–641 (2022).
47. Buyukunal, S. K., Rbaibi Zipak, S. & Muratoglu, K. Microplastics in a traditional Turkish dairy product: ayran. Pol. J. Food Nutr. Sci. 73, 139–150 (2023).
48. Banica, A. L. et al. Microplastics contamination of dairy products with high-fat content-occurrence and associated risks. U. P. B. Sci. Bull. B. 86, 1454–2331 (2024).
49. Schymanski, D., Goldbeck, C., Humpf, H. U. & Fürst, P. Analysis of microplastics in water by micro-Raman spectros copy: release of plastic particles from different packaging into mineral water. Water Res. 129, 154–162 (2018).
50. Sharma, P. Microplastic contamination in food processing: role of packaging materials. Food Sci. Eng. 5, 271–287 (2024).
51. Visentin, E. et al. Preliminary characterization of microplastics in beef hamburgers. Meat Sci. 217, 109626 (2024).
52. Kedzierski, M. et al. Microplastic contamination of packaged meat: Occurrence and associated risks. Food Packag Shelf Life 24, 100489 (2020).
53. Badwanache, P. & Dodamani, S. Qualitative and quantitative analysis of microplastics in milk samples. Indian J. Health Sci. Biomed. Res. KLEU 17, 150–154 (2024).
54. Bintsis, T. & Papademas, P. An overview of the cheesema king process. Global Cheesemaking Technology: Cheese Quality and Characteristics 120–156 (Wiley, 2017).
55. Chibani, N., Djidjelli, H., Dufresne, A., Boukerrou, A. & Nedjma, S. Study of effect of old corrugated cardboard in properties of polypropylene composites: study of mechanical properties, thermal behavior, and morphological properties. J. Vinyl Addit. Technol. 22, 231–238 (2016).
56. Pereira, A. P. D. S., Silva, M. H. P. D., Lima, ÉP., Paula, A. D. S. & Tommasini, F. J. Processing and characterization of PET composites reinforced with geopolymer concrete waste. Mater. Res. 20, 411–420 (2017).
57. Moldovan, A., Patachia, S., Buican, R. & Tierean, M. H. Characterization of polyolefins wastes by FTIR spectroscopy.
Bull. Transilv. Univ. Brasov. Ser. I Eng. Sci. 5, 65–72 (2012).
FUENTE:
Visentin E, Niero G, Benetti F, O’Donnell C, De Marchi M. Assessing microplastic contamination in milk and dairy products. NPJ Sci Food. 2025 Jul 10;9(1):135. doi: 10.1038/s41538-025-00506-8. PMID: 40640169; PMCID: PMC12246066. Published in partnership with Beijing Technology and Business University & International Union of Food Science and Technology



















