Identificación de caseinomacropéptido en aislados de suero de queso
Loria, Karina Gabriela1,2; Fernández, Lucas Damián1; Farías, María Edith1,3
1Departamento de Tecnología – Universidad Nacional de Luján. Luján, Buenos Aires, Argentina.
2CONICET- Consejo Nacional de Investigaciones Científicas y Técnicas. Buenos Aires, Argentina.
3Comisión de Investigaciones Científicas (CIC) de la Provincia de Buenos Aires. Buenos Aires, Argentina.
Resumen
La industria quesera argentina se encuentra ampliamente desarrollada y, como consecuencia de su actividad, se obtienen grandes volúmenes de suero de queso que representa entre el 80 al 90% del volumen total de la leche que ingresa para el procesamiento. El suero de queso es un subproducto líquido obtenido después de la precipitación de la caseína durante la elaboración y posee un gran contenido de materia orgánica que es altamente contaminante una vez vertido al ambiente. Pero lejos de ser un simple desperdicio, el suero contiene poco más del 25% de las proteínas de la leche, alrededor de un 8% de materia grasa, cerca del 95% de lactosa y sales minerales. Esto implica que al menos el 50% (en peso) de los nutrientes de la leche quedan en el suero. El caseinomacropéptido (CMP) es un péptido bioactivo abundante en el suero de queso, con numerosas y valiosas propiedades bioactivas que lo hacen un ingrediente de gran interés comercial. Actualmente el CMP puede conseguirse con un excelente grado de purificación (obtenido por resinas de intercambio iónico) pero con muy alto costo por ser un producto importado. El objetivo de este trabajo fue identificar la presencia del caseinomacropéptido a través de técnicas simples y de bajo costo energético, a partir del suero de queso cuartirolo elaborado en la Planta Piloto de la Universidad Nacional de Luján (CIDETA). El desarrollo de este trabajo tiene una doble ventaja: por un lado, valorizar a los productos del suero y al mismo tiempo evitar la contaminación ambiental que implica el arrojar material orgánico en los cursos de agua. La preparación de los aislados de CMP se realizó calentando el suero de queso desnatado a 90°C por 1 h. Luego se enfrió a temperatura ambiente, se centrifugó a 4°C (4400 rpm, 15 min) y se separó en cuatro fracciones a las cuales se le ajustó el pH a 3,5; 4,0; 4,5 o 5,0 con 1 N HCl. Posteriormente, las muestras se neutralizaron con 1 N NaOH, y se centrifugaron por separado para remover las proteínas precipitadas. Se conservaron los sobrenadantes a -18°C para posteriores ensayos. Se determinó el porcentaje de proteínas por el método de Kjeldahl obteniendo un valor promedio de 0,4 g/100 mL (N x 6,38). La identificación de las proteínas presentes en los aislados se realizó con las técnicas de DLS (dispersión dinámica de luz láser) y de cromatografía líquida de proteínas a alta velocidad (FPLC). Como estándares se usaron concentrados comerciales de CMP (PM: 7,5 KDa), α-lactoalbúmina (PM: 14,2 kDa) y β-lactoglobulina (PM: 18,4 KDa). Los resultados del FLPC confirmaron la detección del CMP a 215 nm y que estuvo presente en los cuatro aislados obtenidos. Las técnicas utilizadas no permitieron cuantificar las proteínas presentes en los concentrados, pero sí identificarlas. La distribución de tamaños de partículas de las muestras obtenidas permitió reconocer la predominancia de CMP en los concentrados obtenidos.
Palabras clave: caseinomacropéptido, péptidos bioactivos, valorización del suero, suero de queso, economía circular.
Introducción
El suero dulce es un subproducto de la elaboración del queso obtenido después de la coagulación de la leche con cuajo. La quimosina actúa sobre la -caseína, rompiendo el enlace peptídico Phe105-Met106, desestabilizando las micelas de caseína que pierden su estabilidad coloidal, se agregan y precipitan. El fragmento insoluble de κ-caseína, para-κ-caseína (fragmento 1-105), permanece en las micelas de caseína, mientras que el caseinomacropéptido (CMP) (fragmento 106-169) permanece soluble en el suero. Se estima que se presenta en alrededor de 1,2-1,5 g L-1 lo que constituye entre el 15-25% de las proteínas de este suero (El-Salam, 2006).
El CMP tiene interés comercial tanto para la industria de alimentos, por sus propiedades funcionales, como para la industria farmacéutica por sus importantes propiedades bioactivas. Actualmente, el CMP puede conseguirse con un excelente grado de pureza, obtenido por resinas de intercambio iónico, pero con alto costo por ser un producto importado. El CMP se destaca del resto de las otras proteínas del suero por su estabilidad al calentamiento (Martínez et al., 2011) y por ser más ácido que el resto de las proteínas, su pI varía desde 3,15 (formas glicosiladas) a 4,1 (formas aglicosiladas) (Kreuß et al., 2009). Martín-Diana et al. (2002) desarrollaron un método para aislar el CMP del concentrado de proteína de suero (WPC) y del suero de queso dulce líquido, basado en estas características particulares del péptido. El procedimiento incluye la acidificación y el calentamiento y la ultrafiltración del suero de queso para dar un polvo de CMP con un contenido de proteína del 75 al 79%, con una pureza entre el 75 y el 90%. Kilic-Akyilmaz et al. (2018) investigaron el impacto del orden de los tratamientos con ácido y calor en la composición del aislado de caseinomacropéptido y recomendaron que el tratamiento térmico se debe aplicar antes de acidificar para reducir el efecto de deglicosilación en el CMP.
El objetivo de este trabajo fue identificar la presencia del caseinomacropéptido a través de técnicas simples y de bajo costo energético, a partir del suero de queso cuartirolo elaborado en la Planta Piloto de la Universidad Nacional de Luján (CIDETA). El desarrollo de este trabajo tiene doble ventaja: por un lado, valorizar a los productos del suero y al mismo tiempo evitar la contaminación ambiental que implica el arrojar material orgánico en los cursos de agua.
Materiales y métodos
Materiales
El suero de queso se obtuvo de la Planta Piloto de la Universidad Nacional de Luján (CIDETA), luego de la elaboración de queso cuartirolo. La leche cruda fue provista por el Centro de Investigación, Docencia y Extensión en Producción Agropecuaria de la Universidad Nacional de Luján (CIDEPA). Dicha leche se desnató y coaguló en la Planta Piloto que produce habitualmente quesos duros, semiduros y blandos. Se utilizaron como estándares de CMP BioPURE-GMP® y β-lactoglobulina Biopure® (β-lg) marcas comerciales de AGROPUR, Inc. (Le Sueur, Minnesota, USA) y de -lactoalbúmina (
-la) de Arla Food Ingredients (Viby J., Dinamarca). El agua ultrapura se obtuvo mediante un sistema de purificación Thermo Scientific Barnstead, modelo Easypure RF.
Preparación de los aislados proteicos
La preparación de los aislados proteicos se realizó según el método desarrollado por Martín-Diana et al. (2002) para aislar CMP del suero de queso dulce líquido, basado en la termoestabilidad del péptido. El procedimiento se realizó calentando el suero de queso desnatado a 90°C por 1 h. Luego se enfrió a temperatura ambiente y se separó en cuatro fracciones a las cuales se le ajustó el pH a 3,5; 4,0; 4,5 o 5,0 con HCl 1 N, rotuladas como M3,5; M4,0; M4,5 y M5,0,respectivamente. Se guardó una muestra de suero sin tratamiento para control (Mc). Posteriormente, las muestras se neutralizaron con NaOH 1 N, y se centrifugaron por separado para remover las proteínas precipitadas (4°C, 4400 rpm, 15 min). Se conservaron los sobrenadantes a -18°C para posteriores ensayos. Para los ensayos de DLS, las muestras en solución fueron almacenadas en freezer a una temperatura de -80ºC durante 24 h y posteriormente liofilizadas (Labconco ® freezone 12) por 48 h hasta obtener una muestra sólida.
Caracterización fisicoquímica
El porcentaje de proteínas se determinó por el método de Kjeldahl (AOAC, 2005) con un factor de N=6,38. Las medidas de pH se realizaron con un pH-metro marca (HI 98191, Hanna Instruments, Italia) y se utilizaron soluciones buffer de pH 4 y 7 para su calibración. La conductividad iónica se determinó a temperatura ambiente con un conductímetro (Hanna Instruments, modelo HI2003-02, Rumania). La acidez titulable se determinó por el método Dornic (AOAC 16ª Ed. 947.05), valorando 10 ml de muestra con solución acuosa de hidróxido de sodio N/9 (0,1 N) marca Alpha Química (Villa María, Córdoba, Argentina) y fenolftaleína como indicador. El contenido de calcio fue analizado por espectroscopía de absorción atómica con un espectrómetro (Modelo AAnalyst 200, Perkin Elmer, CA, USA). Previamente se agregó nitrato de lantano (1,5% p/v) para evitar la interferencia de fosfatos. La viscosidad se midió en un reómetro oscilatorio dinámico con esfuerzo de corte controlado (Physica MCR 301, Anton Paar, Alemania). Se utilizó un sistema de cono y plato CP50 (50 mm de diámetro, 1° de ángulo de cono y 1 mm de separación o gap). La temperatura fue de 25ºC controlada por un baño de agua (Peltier Viscotherm VT2, Paar Physica).
Determinación de tamaños de partículas por DLS
Se determinó la distribución de tamaño de partículas por dispersión dinámica de luz láser (DLS, por sus siglas en inglés: Dynamic Light Scattering) con un equipo Litesizer 500 (Anton Paar Instruments Ltd, Austria). Las mediciones fueron realizadas a 25ºC y con un ángulo fijo de dispersión de 175º. Las muestras fueron previamente filtradas a través de microfiltros Whatman International Ltd. (Maidstone, Inglaterra) de 0,45 y 0,22 μm.
Fraccionamiento de proteínas por FPLC
Los perfiles de proteínas de los aislados fueron analizados por cromatografía de intercambio aniónico en FPLC utilizando una columna mono QTM 5/50 GL (5 x 50 mm, GE Healthcare, Uppsala, Suecia) conectado a un sistema ÄKTA Purifier FPLC (GE Healthcare Life Science, Baied’Urfé, QC, Canadá). La elución se realizó en gradiente con NaCl 1M, con un flujo de 0,5 mL/min y detección en 215 y 280 nm. El procesamiento de datos fue realizado con el software UnicornTM (GE).
Análisis estadístico
Se ajustaron los datos experimentales obtenidos usando GraphPad Prims v8.0.1 (GraphPad Software, San Diego, CA, USA). El análisis estadístico se realizó mediante un análisis de varianza unidireccional (ANOVA) y la prueba de Tukey con un p <0,05.
Resultados y discusión
Caracterización fisicoquímica
En este trabajo se utilizó suero del tipo dulce, de pH inicial de 6,20, proveniente de la producción de queso cuartirolo, obtenido por vía enzimática agregando cuajo. En la Tabla 1 se muestran algunas características fisicoquímicas del suero sin tratamiento (muestra control, Mc) y de las muestras que recibieron tratamiento térmico (90ºC, 1 h) y acidificación a distintos valores de pH: 3,5; 4,0; 4,5 y 5,0, identificadas como (M3,5; M4,0; M4,5 y M5,0 respectivamente) con posterior neutralización. El objetivo de la reducción del pH fue facilitar la precipitación de proteínas de suero que no sean CMP. Las proteínas precipitadas se separaron por centrifugación y se analizó el sobrenadante como el aislado proteico que contiene CMP.
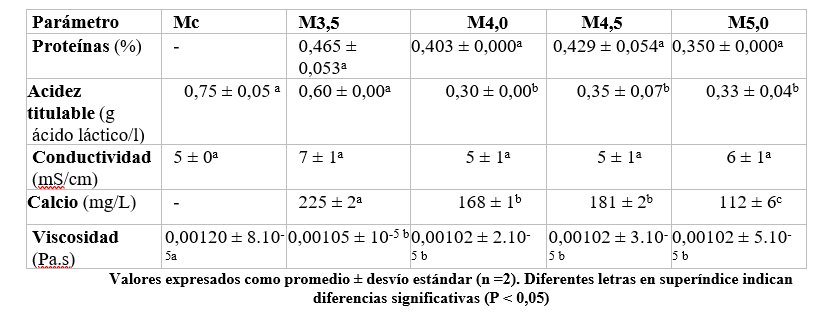
Tabla 1. Caracterización fisicoquímica de los aislados proteicos obtenidos.
Identificación de proteínas por DLS
La Figura 1A muestra las distribuciones de tamaños de partícula por intensidad a 25ºC de soluciones de α-la (PM: 14,2 KDa), β-lg (PM: 18,4 KDa) y CMP (7,5 KDa) al 1% p/p, todas ellas provenientes de concentrados comerciales enriquecidos. Las distribuciones fueron bimodales para α-la y β-lg con un primer pico predominante de diámetro hidrodinámico d(H) de 4,9 y 5,3 nm, respectivamente. Por otro lado, las soluciones de CMP presentaron una distribución trimodal, con un primer pico que se encontró entre 1,2 y 3,8 nm, con un valor máximo de d(H) de 2,0 nm que corresponde a la especie monomérica (Farías et al., 2010). De los gráficos de distribución por volumen (Figura 1B) se deduce que sólo el primer pico de intensidad fue predominante, y los otros picos de mayores d(H) fueron despreciables cuantitativamente. Además, puede notarse que el tamaño de partículas puede ordenarse de menor a mayor: CMP < α-la < β-lg, acorde a sus pesos moleculares.
Figura 1 – Distribución de tamaño de partícula por A) intensidad y B) volumen de soluciones al 1% p/p estándar de α-lactoalbúmina (α-la, ·), β-lactoglobulina (β-lg, ¢) y Caseinomacropéptido (CMP, p) a pH 7.
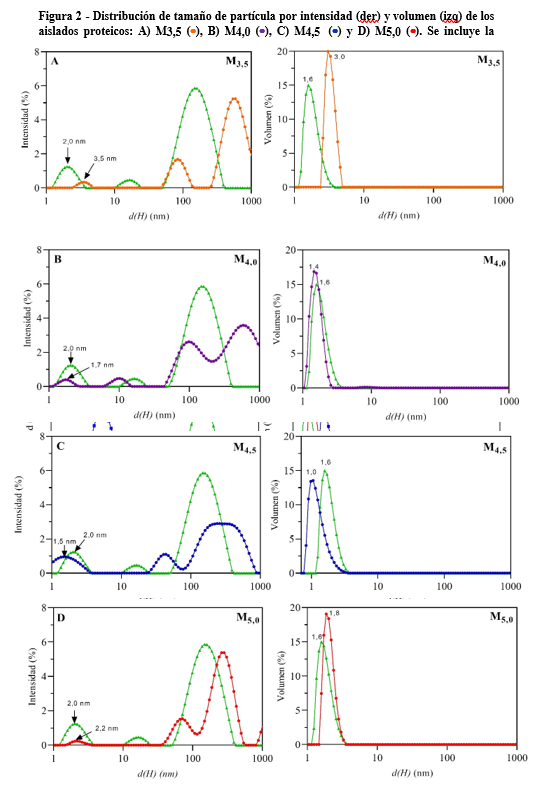
Las distribuciones de tamaño de partículas por intensidad y volumen de las soluciones reconstituidas al 1% p/p de los aislados liofilizados se muestran en la Figura 2. La población predominante fue, para todos los tratamientos, la correspondiente al pico de menor diámetro hidrodinámico (primer pico) según puede observarse en la distribución de tamaño por volumen. El valor máximo de los picos predominantes de los aislados obtenidos fueron de 3,5 nm (M3,5), 1,7 nm (M4,0), 1,5 nm (M4,5) y 2,2 nm (M5,0). Los picos predominantes de M4,0, M4,5 y M5,0 incluyen el pico predominante del CMP incluidos dentro del rango de entre 1,2 y 3,8 nm, como puede verse en las distribuciones por intensidad de la Figura 2 B, C y D. En cambio, el pico predominante de la muestra M3,5 se halló desplazado hacia la derecha (Figura 2 A), tanto en las distribuciones por intensidad como en volumen
Conclusiones
En base a los resultados obtenidos podemos concluir que el tratamiento de calor y acidificación aplicado al suero de queso resultaron eficientes para la obtención de aislados proteicos enriquecidos en CMP. Las técnicas utilizadas no permitieron cuantificar las proteínas presentes en los concentrados, pero sí identificarlas. La distribución de tamaños de partículas de los aislados permitió reconocer la predominancia de CMP presente en ellos. Los resultados del FLPC confirmaron la detección del CMP a 215 nm y que estuvo presente en los cuatro aislados obtenidos. Se detectó, además, la presencia de a-la. Los resultados obtenidos en este trabajo son de utilidad para futuros ensayos que permitan la cuantificación del CMP en los aislados.
Agradecimientos
Los autores agradecen el apoyo financiero de la Universidad Nacional de Luján (UnLu) (RES REC Nº 266-22, DISPCD-TLUJ: 51-21 y DISPCD-TLUJ: 68-22, ANPCyT (PICT-2021- CAT-I-00169) y CONICET. También agradecemos al equipo de Química Analítica de la UnLu, a Andrés Pighin y Emiliano Camilli, que colaboraron con las mediciones de calcio informadas en este trabajo.
Referencias
AOAC. (2005). Official Methods of Analysis of Association of Official Analytical Chemists International, 18th ed. AOAC, USA.
Brody, E. P. (2000). Biological activities of bovine glycomacropeptide. British Journal of Nutrition, 84(SupplementS1), 39-46. doi:doi:10.1017/S0007114500002233
deWit, J. N., & Klarenbeek, G. (1984). Effects of Various Heat Treatments on Structure and Solubility of Whey Proteins. Journal of Dairy Science, 67(11), 2701-2710. doi:https://doi.org/10.3168/jds.S0022- 0302(84)81628-8
El-Salam, M. H. A. (2006). Separation of Casein Glycomacropeptide from Whey: Methods of Potential Industrial Application. International Journal of Dairy Science, 1, 93-99. doi:10.3923/ijds.2006.93.99
Farías, M. E., Martinez, M. J., & Pilosof, A. M. R. (2010). Casein glycomacropeptide pH-dependent self-assembly and cold gelation. International Dairy Journal, 20(2), 79-88. doi:https://doi.org/10.1016/j.idairyj.2009.09.002
Fernández, A., Menéndez, V., & Riera, F. A. (2012). α-Lactalbumin solubilisation from a precipitated whey protein concentrates fraction: pH and calcium concentration effects. 47(3), 467-474. doi:https://doi.org/10.1111/j.1365-2621.2011.02865.x
INTI. (2017). Valorización del lactosuero.
Kilic-Akyilmaz, M., & Dastjerd, A. (2018). Impact of the order of acid and heat treatments on the composition of caseinomacropeptide isolate. International Dairy Journal, 82. doi:10.1016/j.idairyj.2018.02.008
Kreuß, M., Strixner, T., & Kulozik, U. (2009). The effect of glycosylation on the interfacial properties of bovine caseinomacropeptide. Food Hydrocolloids, 23(7), 1818-1826. doi:http://dx.doi.org/10.1016/j.foodhyd.2009.01.011
Lucena, M., Álvarez-Blanco, S., Menéndez, C., Riera, F., & Alvarez, R. (2006). α-Lactalbumin precipitation from commercial whey protein concentrates. Separation and Purification Technology, 52, 446-453.
Martín-Diana, A., Fraga, M., & Fontecha, J. (2002). Isolation and characterisation of caseinmacropeptide from bovine, ovine, and caprine cheese whey. European Food Research and Technology, 214(4), 282-286. doi:10.1007/s00217-001-0452-3
Martinez, M. J., Farías, M. E., & Pilosof, A. M. R. (2011). Casein glycomacropeptide pH-driven self-assembly and gelation upon heating. Food Hydrocolloids, 25(5), 860-867. Retrieved from http://www.sciencedirect.com/science/article/pii/S0268005X10001748
Plank, J., Andres, P. R., Krause, I., & Winter, C. (2008). Gram scale separation of casein proteins from whole casein on a Source 30Q anion-exchange resin column utilizing fast protein liquid chromatography (FPLC).
Protein Expression and Purification, 60(2), 176-181. Doi:https://doi.org/10.1016/j.pep.2008.04.003














