Juan Sebastián Ramírez-Navas
Centro Interdisciplinario de Estudios en Salud – Departamento de Alimentación y Nutrición – Facultad de Ciencias de la Salud, Pontificia Universidad Javeriana, Cali, Colombia.
INTRODUCCIÓN
El color es una de las primeras señales sensoriales percibidas por los consumidores al momento de evaluar un alimento, y desempeña un papel determinante en la aceptación, apetencia y percepción de frescura y calidad[1]. En consecuencia, los colorantes de alimentos se han convertido en herramientas tecnológicas indispensables para la formulación de productos atractivos, estables y competitivos en el comercio. Tradicionalmente, la industria ha recurrido al uso de colorantes sintéticos debido a su alta intensidad cromática, bajo costo, buena estabilidad y facilidad de aplicación en diversas matrices alimentarias. No obstante, la creciente preocupación por sus posibles efectos adversos sobre la salud humana, junto con una demanda sostenida por ingredientes más naturales y seguros, ha incentiva do un giro progresivo hacia el empleo de colorantes naturales. Los pigmentos naturales (extraídos de plantas, microorganismos, algas y hongos) no sólo confieren color, sino que también aportan propiedades bioactivas relevantes y potencial quimio preventivo. Grupos como las antocianinas, carotenoides, clorofilas y betalaínas han sido ampliamente estudiados por su valor funcional, lo que ha reforzado su posicionamiento dentro de tendencias emergentes como el “etiquetado limpio” y el desarrollo de alimentos funcionales. Sin embargo, su aplicación masiva enfrenta múltiples desafíos, entre ellos su baja estabilidad frente a condiciones de procesa miento, su interacción con ingredientes específicos y la variabilidad de su rendimiento según la fuente y el método de obtención.
Asimismo, la sustitución de colorantes sintéticos por naturales implica retos regulatorios, tecnológicos y económicos que deben abordarse mediante investigación interdisciplinaria y colaboración entre sectores productivos y entes normativos. Las exigencias de inocuidad, trazabilidad y estandarización impuestas por organismos internacionales como la EFSA, FDA y JECFA requieren una validación rigurosa de cada pigmento propuesto, especialmente cuan do se emplean tecnologías emergentes como la bio fermentación microbiana, la nano encapsulación o el diseño de envases activos a partir de colorantes naturales sensibles al pH o a la oxidación.
En este contexto, el presente artículo tiene como objetivo analizar los fundamentos científicos, regulatorios, tecnológicos y sensoriales que sustentan el uso de colorantes naturales en la industria alimentaria. Se presentan ejemplos destacados, se discuten sus ventajas y limitaciones y se exploran las estrategias actuales para su estabilización y aplicación, así como las perspectivas de innovación e investigación orientadas a consolidar su papel como ingredientes funcionales en sistemas alimentarios sostenibles y seguros.

CLASIFICACIÓN Y FUNCIÓN TECNOLÓGICA DE LOS COLORANTES DE ALIMENTOS
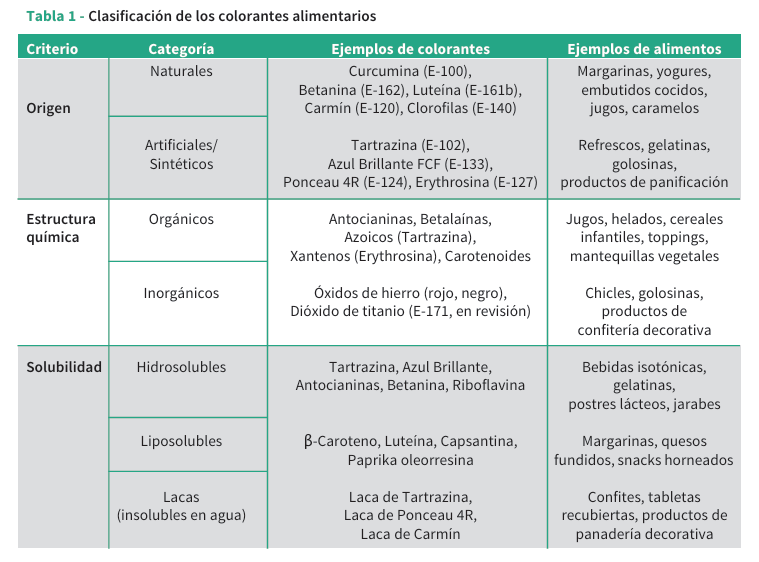
Los colorantes desempeñan una función tecnológica indispensable en la industria de alimentos procesados, no solo por su aporte estético, sino también por su influencia psicológica en la percepción de sabor, frescura y calidad[2,3]. Su clasificación res ponde a criterios de origen, estructura química y comportamiento físico. Según el origen, se dividen en naturales y artificiales; desde el punto de vista químico, pueden ser orgánicos o inorgánicos; mientras que en función de su solubilidad, se agrupan en liposolubles, hidrosolubles o insolubles, siendo estos últimos conocidos como lacas[4]. Según su clasificación se establecen diferencias clave en cuanto a estabilidad, intensidad cromática y compatibilidad con matrices alimentarias específicas(1). Por ejemplo, los colorantes liposolubles como los carotenoides se emplean en matrices ricas en lípidos como margarinas, snacks extruidos y confitería grasa. Por su parte, los hidrosolubles se prefieren en bebidas, gelatinas y productos lácteos. Las lacas, que son pigmentos insolubles adsorbidos sobre un sustrato inerte como el aluminio hidratado, se utilizan cuando se desea una coloración uniforme y estable en productos secos o recubiertos, como galletas, tabletas o confites.
COLORANTES ARTIFICIALES
Los colorantes artificiales, derivados de síntesis química, ofrecen ventajas tecnológicas notables como alta intensidad de color, estabilidad térmica y resistencia a condiciones extremas de procesamiento. Sin embargo, durante las últimas décadas, múltiples agencias internacionales de seguridad alimentaria han intensificado la evaluación del uso de coloran tes sintéticos, motivadas por la acumulación de evidencia sobre sus posibles efectos adversos en la salud humana. Este escrutinio ha conducido a la modificación de niveles de ingesta diaria aceptable (IDA), así como a prohibiciones o restricciones en su aplicación alimentaria. Compuestos como la eritrosina (Rojo Nº 3), el sunset yellow (Amarillo Nº 6), el índigo carmín (Azul Nº 2) y el fast green (Verde Nº 3) han sido evaluados por organismos como la EFSA y el JECFA, debido a preocupaciones sobre su seguri dad toxicológica. Las principales inquietudes inclu yen posibles efectos sobre neurotransmisores, reacciones alérgicas y alteraciones de tipo neuroconduc tual, especialmente en poblaciones pediátricas[5, 6]. En particular, los colorantes azoicos han generado controversias relevantes. La tartrazina (Amarillo Nº 5) y el Amarillo Nº 6 han sido asociados con síntomas de hiperactividad infantil y con respuestas inmuno lógicas adversas, lo que ha derivado en su etiqueta do obligatorio en la legislación alimentaria de la Unión Europea. La eritrosina ha demostrado, en estudios experimentales, potencial genotóxico y alteraciones en rutas de señalización neuronal, lo que ha justificado una revisión crítica de su empleo[6]. Aunque varios de estos colorantes mantienen su autorización por parte de organismos regulatorios, muchos de los valores de IDA establecidos no han sido actualizados en más de una década, lo cual limita la vigencia de las actuales medidas de protección del consumidor[7].
Las evaluaciones toxicológicas contemporáneas incorporan enfoques más integrales, que consideran fenómenos como bioacumulación, epigenotoxi cidad y trastornos conductuales subclínicos. En este contexto, se ha fortalecido la transición hacia pig mentos naturales, percibidos como alternativas más seguras pese a sus limitaciones tecnológicas. La investigación actual se dirige a generar evidencia científica robusta y actualizada que fundamente decisiones regulatorias proporcionales a los riesgos reales y a los beneficios funcionales de cada aditivo colorante. Estas evaluaciones buscan equilibrar la seguridad del consumidor con la viabilidad tecnoló gica y económica del sistema alimentario[8,9].
COLORANTES NATURALES
En contraste, los colorantes naturales han ganado protagonismo debido a las preocupaciones de salud pública y una preferencia creciente por productos de origen natural[10,11]. Estos compuestos no solo tiñen, sino que también pueden ejercer efectos antioxidantes, antiinflamatorios y potencialmente protectores frente a enfermedades crónicas[11,12]. Sin embargo, su aplicación industrial plantea retos significativos. La estabilidad frente a luz, oxígeno y pH suele ser limitada, lo que afecta su intensidad cromática y vida útil[13]. Además, la percepción de naturalidad depende del conocimiento del consumidor sobre el ingrediente y su procesamiento, lo cual puede incidir en su aceptación[14]. A ello se suma la necesidad de adaptar las tecnologías de extracción y formulación mediante estrategias como la microencapsulación y el uso de agentes estabilizantes, para mejorar la funcionalidad y permanencia del color en condiciones industriales[2].
Los colorantes naturales están reemplazando progresivamente a los sintéticos en diversas categorías de alimentos, especialmente en bebidas, productos lácteos, confitería y panificación, en respuesta a la demanda de menor carga de aditivos percibidos como artificiales[15-17]. Betalaínas, carotenoides, ficocianinas y antocianinas son los grupos más empleados, tanto por su capacidad tintórea como por sus posibles beneficios sobre la salud[13,18,19]. Estos pigmentos naturales han estimulado investigaciones enfocadas en su estabilización, optimización de extracción y ampliación de su espectro de aplicaciones, consolidando una tendencia hacia productos más saludables y tecnológicamente viables[20, 21].

FUENTES Y CARACTERÍSTICAS DE LOS COLORANTES NATURALES
Los colorantes naturales derivan principalmente de plantas, pero también de hongos, algas, bacterias, levaduras y residuos agroindustriales[22]. Su composición química es estructuralmente diversa, agrupándose en varias familias pigmentarias con propiedades fisicoquímicas distintivas que determinan su comportamiento tintóreo y su viabilidad tecnológica[23, 24]. Cada clase pigmentaria presenta propiedades específicas de solubilidad, estabilidad y coloración. Las antocianinas son flavonoides hidrosolubles cuya coloración varía con el pH del medio, predominando en frutos rojos como moras y uvas. Los carotenoides, de naturaleza lipofílica, producen tonos amarillos, naranjas y rojos y están presentes en hortalizas como zanahorias y tomates. Las clorofilas, localizadas en tejidos foliares, confieren tonalidades verdes, aunque su degradación en ambientes ácidos o térmicos limita su uso. Las betalaínas, altamente solubles en agua, provienen de la remolacha y de ciertas cactáceas y aportan matices rojos o púrpuras. Los curcuminoides, como la curcumina del rizoma de Curcuma longa, generan un color amarillo intenso y exhiben actividad antioxidante comprobada[19].
A pesar de sus propiedades bioactivas, estos pigmentos enfrentan limitaciones tecnológicas. En comparación con los colorantes sintéticos, poseen menor estabilidad frente a la oxidación, la exposición lumínica y el calor, además de una fuerza tintórea reducida en algunas matrices alimentarias[11, 25,26]. Para superar estas limitaciones, se desarrollan tecnologías de estabilización, como la microencapsulación con biopolímeros, sistemas emulsionados multicomponente y estructuras liposomales, así como el aprovechamiento de nuevas fuentes pigmentarias a partir de subproductos vegetales o cultivos de microorganismos[27].
La industria alimentaria incorpora estos colorantes en productos lácteos, bebidas, panificados y confites, considerando parámetros como la compatibilidad con la matriz, la interacción con ingredientes funcionales y la aceptación sensorial del consumidor. El diseño racional de formulaciones se orienta a optimizar rendimiento y estabilidad sin comprometer atributos organolépticos[28]. Las investigaciones recientes exploran el desarrollo de colorantes naturales más funcionales, estables y adaptables, que satisfagan tanto las exigencias regulatorias como las expectativas del mercado contemporáneo[21].
EJEMPLOS DE COLORANTES NATURALES
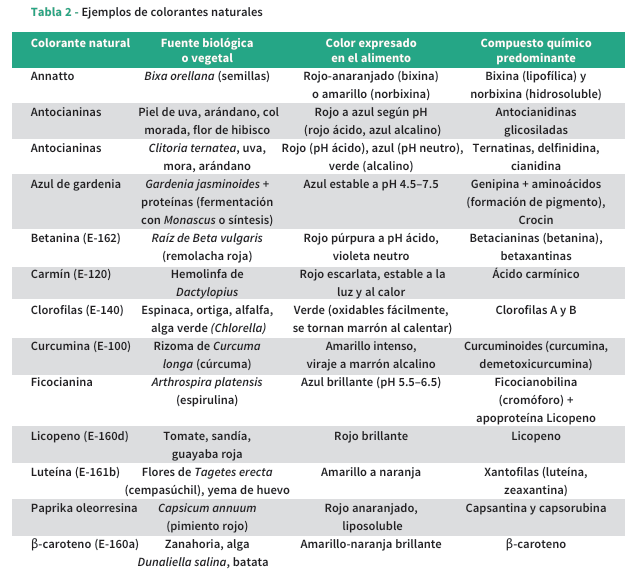
Entre los pigmentos naturales de mayor relevancia industrial destacan el azul de gardenia, las antocianinas de Clitoria ternatea, la curcumina, las betalaínas del betabel, la ficocianina de espirulina y los carotenoides del annatto, todos ellos caracterizados por su potencial tintóreo y bioactividad funcional.
Azul de gardenia. Se genera a partir de genipina, un iridoide extraído de Gardenia jasminoides (Jazmín del Cabo), que forma pigmentos azules mediante reacciones de entrecruzamiento con aminoácidos y proteínas[29]. Su estabilidad ante variaciones de pH, temperatura y luz es superior a la de otros pigmentos azules conocidos[30,31]. Las técnicas de extracción incluyen métodos convencionales y tecnologías avanzadas como ultrasonido o fluidos supercríticos[32]. También se han desarrollado procesos fermentativos con Leifsonia sp. a partir de residuos agroindustriales[33]. Este pigmento ha demostrado buena compatibilidad en productos lácteos, confitería y bebidas, y se explora su aplicación en impresión 2D y 3D de alimentos, donde la leche representa un medio ideal para su formación por su contenido de aminoácidos y su pH ligeramente ácido[34].

Antocianinas. La flor de guisante de mariposa (Clitoria ternatea) es fuente de antocianinas tipo ternatinas, responsables de un intenso color azul en condiciones de pH ácido a neutro[35]. Los extractos se obtienen mediante infusión o sonicación, y presentan buena estabilidad térmica y aceptable resistencia a cambios de pH[36,37]. Su funcionalidad se ha potenciado mediante técnicas de encapsulación con biopolímeros[38]. Su aplicación se extiende a bebidas, confites y sistemas de envasado inteligente, donde el cambio de color inducido por el pH se utiliza como indicador de frescura[39].

Curcumina. Principal pigmento del extracto de cúrcuma (Curcuma longa), es un compuesto amarillo de reconocida actividad antioxidante, antiinflamatoria y antimicrobiana. Se utiliza ampliamente en productos cárnicos, lácteos y bebidas funcionales[40,41]. Su capacidad cromática dependiente del pH permite su integración en envases inteligentes[42]. Sin embargo, su escasa solubilidad y baja biodisponibilidad han impulsado el desarrollo de formulaciones como nanocurcumina, encapsulados lipídicos y matrices biodegradables comestibles para aplicaciones alimentarias[43-45].

Betalaínas. El betabel o remolacha (Beta vulgaris) constituye la principal fuente industrial de betalaínas, pigmentos hidrosolubles divididos en betacianinas (rojo-violeta) y betaxantinas (amarillo-anaranjado). Estos compuestos presentan actividad antioxidante, capacidad de neutralización de radicales libres y posibles efectos beneficiosos sobre la salud cardiovascular y cognitiva[46,47]. No obstante, su estabilidad se ve comprometida por factores como la exposición a luz, oxígeno, cambios de pH y temperatura[48]. Las estrategias actuales incluyen encapsulación, mejora de condiciones de extracción y búsqueda de fuentes pigmentarias alternativas[49]. La betanina, pigmento dominante del betabel, es ampliamente empleada en bebidas, suplementos y productos funcionales[50].

Ficocianina. Extraída de la cianobacteria Arthrospira platensis (espirulina), es un pigmento azul con aplicaciones tanto tintóreas como nutra céuticas. Su estabilidad óptima se sitúa en el rango de pH 5.5–6.0 y a temperaturas por debajo de 45°C[51, 52]. Dada su labilidad frente a la luz y el calor, se han desarrollado sistemas de encapsulación y uso de conservantes naturales para aumentar su vida útil[53]. Su purificación industrial emplea técnicas como precipitación con sulfato de amonio y cromatografía líquida[51]. Su uso se ha extendido a alimentos funcionales, cosméticos y formulaciones farmacéuticas, y se proyecta que su mercado alcance los 279.6 millones de dólares para 2030[54].

Annatto. Pigmento carotenoide derivado de las semillas de Bixa orellana, contiene bixina (lipofílica) y norbixina (hidrosoluble), ampliamente empleadas en quesos, productos cárnicos y grasas alimentarias[55, 56]. Su extracción se realiza mediante disolventes orgánicos, microondas o tecnologías super críticas[57]. Con buena estabilidad térmica hasta los 180°C y efectos antioxidantes comprobados, el annatto se ha consolidado como una opción preferida en formulaciones sin aditivos sintéticos[58-60].

VENTAJAS Y DESAFÍOS TECNOLÓGICOS
La aplicación de colorantes naturales a nivel industrial plantea múltiples desafíos tecnológicos que limitan su desempeño frente a los colorantes sintéticos en términos de estabilidad, intensidad cromática y funcionalidad en matrices complejas[13, 27]. La estabilidad fisicoquímica de estos pigmentos se ve afectada por variables críticas como el pH del alimento, la temperatura del procesamiento térmico, la exposición a la luz y la presencia de oxígeno disuelto. Por ejemplo, las antocianinas exhiben alta sensibilidad a medios alcalinos, donde pueden perder su capacidad tintórea o derivar en productos incoloros, mientras que los carotenoides presentan alta susceptibilidad a procesos oxidativos[23,48].
Adicionalmente, la naturaleza de la matriz alimentaria influye de manera significativa en el comportamiento del pigmento. Sistemas grasos, proteicos, acuosos o ricos en azúcares alteran no sólo la estabilidad del colorante, sino también su biodisponibilidad y su interacción molecular con otros componentes, afectando así el perfil sensorial final del pro ducto.
Para mitigar estas limitaciones, se han desarrollado diversas estrategias de protección estructural, entre las que destacan tecnologías de encapsulación, como la microencapsulación con biopolímeros, la inclusión en nanopartículas y la formación de emulsiones múltiples. Estas metodologías permiten estabilizar los compuestos bioactivos frente a agentes degradativos, mejoran su dispersión en el medio alimentario y prolongan su vida útil sin comprometer su actividad funcional[17, 23]. Este enfoque tam bién ha sido útil para incrementar la eficacia de pigmentos con baja biodisponibilidad, como la curcumina, y extender sus aplicaciones más allá de la mera función colorante.
El desarrollo de formulaciones robustas, capaces de reproducir el comportamiento funcional de los colorantes sintéticos, sigue siendo un objetivo prioritario para su adopción masiva en entornos industriales. La adaptación de los parámetros de procesamiento (tipo de tratamiento térmico, intensidad de presión, duración de la exposición) es esencial para mantener la integridad estructural del pigmento natural[13]. No obstante, la generalización de su uso aún exige estudios complementarios, particularmente en aspectos de seguridad toxicológica y validación regulatoria, que sustenten su empleo a largo plazo como aditivos funcionales y seguros[11].

ESTRATEGIAS TECNOLÓGICAS PARA SU APLICACIÓN INDUSTRIAL
La incorporación efectiva de colorantes naturales en alimentos requiere soluciones tecnológicas diseña das para preservar sus propiedades cromáticas y bioactivas durante el procesamiento, almacenamiento y distribución. En este contexto, técnicas como la microencapsulación, la coacervación compleja y el uso de sistemas emulsificados o matrices lipídicas han sido ampliamente estudiadas. Estas tecnologías permiten aislar el colorante del entorno hostil, minimizando su degradación y aumentando su persistencia en diversas condiciones de procesamiento[17,61]. Resultan particularmente eficaces en pigmentos termolábiles como antocianinas, betalaínas y carotenoides, cuya estructura química es vulnerable a procesos oxidativos o térmicos[23,27].
La nanoencapsulación ha emergido como una estrategia innovadora que no sólo incrementa la estabilidad del colorante, sino que también mejora su bioactividad y per mite una liberación controlada. Técnicas como la gelificación iónica, la emulsificación y la adsorción se han utiliza do para diseñar vehículos capaces de proteger y liberar selectivamente el pigmento, mejorando así su biodisponibilidad en la matriz alimentaria[62,63]. Estas formulaciones abordan eficazmente la baja compatibilidad de muchos colorantes naturales con condiciones industriales intensivas, facilitando su integración en productos alimenticios sin afectar su calidad sensorial o seguridad[64]. Actualmente, la investigación se orienta hacia la optimización de estos sistemas y la reducción de sus costos, con el objetivo de permitir su adopción a gran escala en aplicaciones comerciales[65].
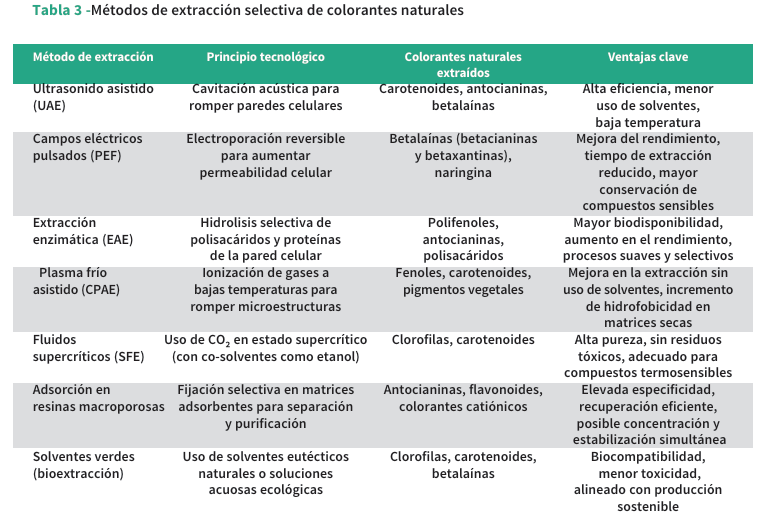
El desempeño funcional de los colorantes también depende de su interacción con ingredientes específicos de cada formulación[27, 47]. Ante ello, se han desarrollado métodos de extracción selectiva (2), tecnologías de estabilización adaptadas y formulaciones que mejoran la compatibilidad del colorante con distintas matrices[66]. La industria alimentaria ha comenzado a implementar estas soluciones para responder a la demanda por productos naturales, sostenibles y saludables[13, 23].
Por otra parte, la autenticidad y trazabilidad de los colorantes naturales requieren herramientas analíticas precisas, capaces de cuantificar compuestos bioactivos, detectar adulteraciones y garantizar la conformidad con los estándares regulatorios. Las técnicas cromatográficas, como HPLC acoplada a detección UV-Vis o fluorescencia, permiten la caracterización detallada y la estandarización de extractos pigmentarios[67,68]. Además, tecnologías espectroscópicas como la NIR y la imagen hiperespectral permiten análisis no destructivos en tiempo real, útiles para aplicaciones industriales en línea. Métodos de alta especificidad como LC-MS o GC-MS permiten la identificación de trazas, contaminantes o productos de degradación con alta sensibilidad[69, 70]. La adecuada preparación de muestras, ajustada a la naturaleza del alimento y del pigmento, resulta esencial para garantizar la reproducibilidad y precisión de los análisis[71]. Dado que la estabilidad sigue siendo una limitante, el monitoreo analítico a lo largo del ciclo de vida del producto se vuelve indispensable. Estas herramientas permiten verificar la integridad estructural del pigmento, detectar modificaciones no deseadas y documentar el cumplimiento normativo[61]. En un entorno donde la transición hacia ingredientes naturales es cada vez más marcada, los métodos analíticos robustos no sólo refuerzan el control de calidad, sino que también consolidan la confianza del consumidor mediante la transparencia y la autenticidad en la cadena de suministro[72, 73].
IMPLICACIONES REGULATORIAS, SENSORIALES Y COMERCIALES
Las diferencias normativas internacionales sobre colorantes alimentarios configuran un escenario heterogéneo, determinado por enfoques legislativos, marcos científicos y valores socioculturales. Aunque existe un consenso técnico en torno a la evaluación del riesgo, las políticas de autorización, etiquetado y restricción varían entre regiones, condicionando la dinámica del comercio global. Estas divergencias obligan a los fabricantes a adaptar formulaciones, declaraciones y controles de calidad según el mercado de destino[74-76]. La Unión Europea, mediante la EFSA, mantiene un enfoque precautorio que exige revisiones periódicas y etiquetado obligatorio para ciertos colorantes asocia dos a efectos neuroconductuales, como la tartrazina. En contraste, la FDA estadounidense diferencia entre colorantes sujetos a certificación y aquellos exentos, sin requerir advertencias específicas. Japón aplica un listado aún más restrictivo, guiado por criterios autónomos que reflejan percepciones nacionales sobre seguridad y aceptación cultural. En países como India y Brasil se observa una tendencia hacia la revisión periódica de listas positivas, en concordancia con nuevas evidencias científicas y demandas de los consumidores[26]. Estas disparidades han motivado iniciativas de armonización lideradas por el Codex Alimentarius, enfocadas en estandarizar criterios de evaluación toxicológica y regulatoria. Sin embargo, estas propuestas enfrentan obstáculos técnicos y políticos, en especial por la falta de actualización de algunos dictámenes toxicológicos sobre colorantes sintéticos, que no han sido revisados en más de una década[7,77].
Desde una perspectiva regulatoria, los coloran tes naturales requieren evaluaciones rigurosas antes de su autorización. Organismos como la FDA, la EFSA y el JECFA aplican protocolos que consideran genotoxicidad, metabolismo, carcinogenicidad y exposición dietética. Aunque algunos pigmentos pueden ser clasificados como GRAS o recibir números INS o códigos E, la percepción de seguridad debe estar sustentada en evidencia robusta, especial mente en matrices complejas o aplicaciones tecno lógicas innovadoras[8,72,78]. La aceptación sensorial y la eficacia tecnológica de estos pigmentos también dependen de su compatibilidad con formulaciones específicas, su estabilidad y su efecto sobre atributos organolépticos.
En el plano comercial, el etiquetado limpio ha incrementado la demanda por ingredientes “natura les”, percibidos como saludables, sostenibles y auténticos. Esta tendencia influye en decisiones de compra, estrategias de posicionamiento y diseño de productos funcionales[11,79]. Los colorantes natura les pueden enriquecer la narrativa sensorial y funcional del alimento, pero también modificar sabor, aroma o textura, dependiendo de su concentración y medio de aplicación. Estos efectos deben ser gestionados mediante estudios sensoriales y formulaciones balanceadas que aseguren la aceptación del consumidor final.
Desde el punto de vista económico, el uso de pigmentos naturales implica costos más elevados que sus contrapartes sintéticas. Este aumento se asocia a menor rendimiento, sensibilidad a condiciones ambientales, estacionalidad de cultivos y necesidad de tecnologías específicas de extracción y estabilización[13]. No obstante, su valorización ambiental es creciente, especialmente cuando se obtienen a partir de subproductos agroindustriales, enmarcándose en modelos de economía circular[79,80]. En estos casos, las antocianinas y otros pigmentos han sido destacados por su menor huella ecológica y su potencial de sostenibilidad.
La trazabilidad, autenticidad y estandarización son factores esenciales para la integración efectiva de estos colorantes en cadenas de suministro globa les. Requieren proveedores certificados, prácticas agrícolas sostenibles y sistemas analíticos que validen la composición del ingrediente[23]. La investigación futura deberá priorizar el desarrollo de procesos adaptativos, nuevas fuentes pigmentarias y estrategias de formulación que permitan sustituir los colorantes sintéticos de manera funcional, sensorial y económicamente viable[13, 78].
PERSPECTIVAS DE INNOVACIÓN E INVESTIGACIÓN FUTURA
Las líneas de innovación más recientes se dirigen hacia la identificación de fuentes pigmentarias no convencionales y el empleo de herramientas de bioingeniería para mejorar la producción, estabilidad y funcionalidad de estos compuestos. En este contexto, microorganismos como Galdieria sulphuraria, Monascus spp. y Spirulina platensis se posicionan como plataformas productoras atractivas, tanto por su diversidad cromática como por su potencial para procesos biotecnológicos escalables en condiciones controladas[22, 81]. La aplicación de ingeniería metabólica y biología sintética ha permitido el diseño de “fábricas celulares” capaces de sintetizar pigmentos naturales de forma más eficiente y predecible, disminuyendo la dependencia de cultivos vegetales y minimizando variaciones estacionales[82,83]. No obstante, la implementación industrial de estas soluciones enfrenta desafíos técnicos y regulatorios, como la estabilidad del pigmento durante el procesamiento, la viabilidad económica del sistema biotecnológico y la aceptación por parte de los marcos regulatorios en diferentes regiones[84]. Paralelamente, se investiga la funcionalización de pigmentos mediante propiedades fotocromáticas o sinergias con antioxidantes naturales, lo que permitiría generar ingre dientes multifuncionales que integren coloración, bioactividad y funcionalidades sensoriales específicas.
Para enfrentar los retos pendientes, se requiere una aproximación interdisciplinaria que combine avances en nanotecnología, ciencia de materiales, ingeniería bioquímica y tecnologías alimentarias. Esta integración es indispensable para diseñar sistemas de encapsulación más eficientes, incrementar la biodisponibilidad de los pigmentos y lograr formulaciones estables adaptadas a matrices complejas[85]. También, las investigaciones futuras deberán centrarse en la optimización de las propiedades fisicoquímicas de los pigmentos naturales sin alterar su carácter regulatorio como ingredientes “limpios”. Esto incluye el ajuste de parámetros de solubilidad, intensidad cromática y reactividad molecular, así como el diseño de matrices protectoras que prolonguen la estabilidad funcional del pigmento en condiciones industriales exigentes. Asimismo, se vuelve imprescindible evaluar los impactos ambientales asociados a su producción, considerando análisis de ciclo de vida, eficiencia energética y potencial de integración en sistemas de bioeconomía circular.
PALABRAS FINALES
La sostenibilidad emerge como un eje transversal que justifica y orienta la transición hacia colorantes naturales. Su producción a partir de residuos agroindustriales, la integración en sistemas de bioeconomía circular y el desarrollo de tecnologías limpias ofrecen oportunidades reales para reducir la huella ecológica del sistema alimentario. No obstante, alcanzar una sustitución funcional y sensorial completa exige esfuerzos coordinados entre ciencia, industria y regulación. En este escenario, los colorantes naturales no deben concebirse únicamente como sustitutos cromáticos, sino como ingredientes estratégicos con capacidad para redefinir la relación entre tecnología alimentaria, salud pública y sostenibilidad planetaria.
REFERENCIAS
1. Ramírez-Navas JS. Quality parameters of Sweetened Concentrated Milk Products. In: Sweetened Concentrated Milk Products. UK: Woodhead Publishing; 2024. p. 143-64 https://doi.org/10.1016/b978-0-12-823373-3.00004-8
2. Silva MM, et al. Foods. 2022;11(3):379. https://doi.org/10.3390/foods11030379
3. Ramírez-Navas JS. Tecnol Láct Lat Am. 2010;61:52-8.
4. Clemens R, et al. Nutr Today. 2018;53(4):169-73. https://doi.org/10.1097/nt.0000000000000285
5. Barciela P, et al. Food Chem Toxicol. 2023;178:113935. https://doi.org/10.1016/j.fct.2023.113935
6. Chappell GA, et al. Food Chem Toxicol. 2020;140:111310. https://doi.org/10.1016/j.fct.2020.111310
7. Amchova P, et al. Toxics. 2024;12(7):466. https://doi.org/10.3390/toxics12070466
8. Sunday NO, et al. Pharm Biosci J. 2016:01-11. https://doi.org/10.20510/ukjpb/4/i4/110639
9. Ambroziewicz ZM, et al. J Educ Health Sport. 2024;76:56522. https://doi.org/10.12775/jehs.2024.76.56522
10. Aberoumand A. World J Dairy Food Sci. 2011;6(1):71-8.
11. de Mejia EG, et al. Annu Rev Food Sci Technol. 2020;11(1):145-82. https://doi.org/10.1146/annurev-food 032519-051729
12. Campo LM, et al. 2021;8(1):23-41. https://doi.org/https://doi.org/10.23850/24220582.3982
13. Luzardo-Ocampo I, et al. Foods. 2021;10(3):634. https://doi.org/10.3390/foods10030634
14. Murley T, et al. Foods. 2019;8(8):317. https://doi.org/10.3390/foods8080317
15. Echegaray N, et al. Food Chem. 2023;404:134453. https://doi.org/10.1016/j.foodchem.2022.134453
16. Ghosh S, et al. Crit Rev Food Sci Nutr. 2022;64(6):1508-52. https://doi.org/10.1080/10408398.2022.2117785
17. Ghosh S, et al. LWT. 2022;153:112527. https://doi.org/10.1016/j.lwt.2021.112527
18. Dey S, et al. Food Chem Adv. 2022;1:100019. https://doi.org/10.1016/j.focha.2022.100019
19. Singh T, et al. J Agric Food Res. 2023;12:100628. https://doi.org/10.1016/j.jafr.2023.100628
20. Coultate T, et al. Color Technol. 2018;134(3):165-86. https://doi.org/10.1111/cote.12334
21. Vega EN, et al. Foods. 2023;12(22):4102. https://doi.org/10.3390/foods12224102
22. Dufossé L, et al. Curr Opin Biotechnol. 2014;26:56-61. https://doi.org/10.1016/j.copbio.2013.09.007
23. Jurić S, et al. Food Res Int. 2020;38(8):1735-90. https://doi.org/10.1080/87559129.2020.1837862
24. Sanna D, et al. Nutraceuticals. 2022;2(4):365-83. https://doi.org/10.3390/nutraceuticals2040028
25. Sigurdson GT, et al. Annu Rev Food Sci Technol. 2017;8(1):261-80. https://doi.org/10.1146/annurev-food 030216-025923
26. Mota IGC, et al. Food Res Int. 2021;39(3):1578-93. https://doi.org/10.1080/87559129.2021.1934694
27. Wijesekara T, et al. Food Res Int. 2024;179:114011. https://doi.org/10.1016/j.foodres.2024.114011
28. Nabi BG, et al. Food Biosci. 2023;52:102403. https://doi.org/10.1016/j.fbio.2023.102403
29. Rizwan A, et al. Food Chem. 2024;434:137498. https://doi.org/10.1016/j.foodchem.2023.137498
30. Paik Y-S, et al. J Agric Food Chem. 2000;49(1):430-2. https://doi.org/10.1021/jf000978f
31. Wang H, et al. Food Chem. 2023;401:134119. https://doi.org/10.1016/j.foodchem.2022.134119
32. Prado JM, et al. CAC. 2020;16(5):504-32. https://doi.org/10.2174/1573411014666181115125740
33. He Y, et al. Fermentation. 2022;8(10):503. https://doi.org/10.3390/fermentation8100503
34. Neves MIL, et al. Food Res Int. 2022;157:111240. https://doi.org/10.1016/j.foodres.2022.111240
35. Vidana Gamage GC, et al. Front Plant Sci. 2021;12. https://doi.org/10.3389/fpls.2021.792303
36. Fu X, et al. Molecules. 2021;26(22):7000. https://doi.org/10.3390/molecules26227000
37. Hasanah NN, et al. Polymers. 2023;15(11):2541. https://doi.org/10.3390/polym15112541
38. Lourith N, et al. J Soc Cosmet Chem. 2020;71(1).
39. Shirodkar SM, et al. Applied Sciences. 2023;13(12):7141. https://doi.org/10.3390/app13127141
40. Buniowska-Olejnik M, et al. J Food Sci. 2024;89(9):5245 54. https://doi.org/10.1111/1750-3841.17278
41. El-Saadony MT, et al. Front Nutr. 2023;9. https://doi.org/10.3389/fnut.2022.1040259
42. Roy S, et al. Food Chem. 2022;375:131885. https://doi.org/10.1016/j.foodchem.2021.131885
43. Li J, et al. Food Res Int. 2024;40(10):3487-507. https://doi.org/10.1080/87559129.2024.2360539
44. Oliveira Filho JGd, et al. Trends Food Sci Technol. 2021;118:840-9. https://doi.org/10.1016/j.tifs.2021.11.005
45. Renita AA, et al. Foods. 2023;12(7). https://doi.org/10.3390/foods12071521
46. Fu Y, et al. J Agric Food Chem. 2020;68(42):11595-611. https://doi.org/10.1021/acs.jafc.0c04241
47. Martins N, et al. Food Funct. 2017;8(4):1357-72. https://doi.org/10.1039/c7fo00144d
48. Calva-Estrada SJ, et al. Food Chem Mol Sci. 2022;4:100089. https://doi.org/10.1016/j.fochms.2022.100089
49. Ciriminna R, et al. ACS Sustainable Chem Eng. 2018;6(3):2860-5. https://doi.org/10.1021/acssuschemeng.7b04163
50. Punia Bangar S, et al. Crit Rev Food Sci Nutr. 2022;63(26):8403-27. https://doi.org/10.1080/10408398.2022.2055529
51. Fernandes R, et al. Pharmaceuticals. 2023;16(4):592. https://doi.org/10.3390/ph16040592
52. Yu Z, et al. Food Res Int. 2024;186:114362. https://doi.org/10.1016/j.foodres.2024.114362
53. Adjali A, et al. J Pharm Anal. 2022;12(3):406-14. https://doi.org/10.1016/j.jpha.2021.12.005
54. Athiyappan KD, et al. Food Human. 2024;2:100235. https://doi.org/10.1016/j.foohum.2024.100235
55. Biruk H, et al. J Agron Technol Eng Manag. 2022;5(1):687 96.
56. Sharma P, et al. Comp Rev Food Sci Food Safe. 2019;19(4):1220-42. https://doi.org/10.1111/1541-4337.12519
57. Garcia CER, et al. Cienc Rural. 2012;42(8):1510-7. https://doi.org/10.1590/s0103-84782012000800029
58. Akakpo E, et al. Int J Bio Chem Sci. 2019;13(4):2332. https://doi.org/10.4314/ijbcs.v13i4.36
59. Giridhar P. J Sci Res Rep. 2014;3(2):327-48. https://doi.org/10.9734/jsrr/2014/5870
60. Nurtiana W, et al. AGRORADIX. 2023;7(1):117-27. https://doi.org/10.52166/agroteknologi.v7i1.5243
61. Nedamani A, R. Res Innov Food Sci Technol. 2022;10(4):369-88. https://doi.org/10.22101/JRIFST.2022.277772.1235 62. Bhandari M, et al. Pigment Resin Technol. 2022;53(1):53 61. https://doi.org/10.1108/prt-04-2022-0050
63. Luiza Koop B, et al. Food Res Int. 2022;153:110929. https://doi.org/10.1016/j.foodres.2021.110929
64. Singh S, et al. J Food Process Eng. 2023;46(12). https://doi.org/10.1111/jfpe.14311
65. Socaciu C. Bull USAMV-CN. 2007;63:64. https://doi.org/10.15835/BUASVMCN-ASB:64:1-2:2185
66. Molina AK, et al. Molecules. 2023;28(3):1200. https://doi.org/10.3390/molecules28031200
67. Custodio-Mendoza JA, et al. Molecules. 2024;29(8):1735. https://doi.org/10.3390/molecules29081735
68. Parys W, et al. Processes. 2021;9(7):1100. https://doi.org/10.3390/pr9071100
69. Donno D, et al. Foods. 2020;9(12):1734. https://doi.org/10.3390/foods9121734
70. Park J, et al. Food Chem. 2024;459:140333. https://doi.org/10.1016/j.foodchem.2024.140333
71. Ntrallou K, et al. Foods. 2020;9(1):58. https://doi.org/10.3390/foods9010058
72. Scotter MJ. Qual Assur Saf Crops Foods. 2011;3(1):28-39. https://doi.org/10.1111/j.1757-837x.2010.00087.x
73. Wadood SA, et al. Microchem J. 2020;152:104295. https://doi.org/10.1016/j.microc.2019.104295
74. Lalor F, et al. Br Food J. 2011;113(2):298-313. https://doi.org/10.1108/00070701111105358
75. Lehto S, et al. Food Addit Contam Part A. 2017;34(3):335 55. https://doi.org/10.1080/19440049.2016.1274431
76. Magnuson B, et al. Food Addit Contam Part A. 2013;30(7):1147-220. https://doi.org/10.1080/19440049.2013.795293 77. Amchova P, et al. Regul Toxicol Pharmacol. 2015;73(3):914-22. https://doi.org/10.1016/j.yrtph.2015.09.026
78. Weiss V, et al. Food Saf Health. 2023;1(2):107-9. https://doi.org/10.1002/fsh3.12015
79. Pereira H, et al. Trends Food Sci Technol. 2024;143:104249. https://doi.org/10.1016/j.tifs.2023.104249
80. Gebhardt B, et al. J Clean Prod. 2020;260:120884. https://doi.org/10.1016/j.jclepro.2020.120884
81. Ramesh C, et al. Microorganisms. 2019;7(7):186. https://doi.org/10.3390/microorganisms7070186
82. Seo S-O, et al. Annu Rev Food Sci Technol. 2022;13(1):463 88. https://doi.org/10.1146/annurev-food-052720-012228 83. Thomsen PT, et al. Curr Opin Chem Biol. 2024;81:102477. https://doi.org/10.1016/j.cbpa.2024.102477
84. Sen T, et al. Front Nutr. 2019; 6. https://doi.org/10.3389/fnut.2019.00007
85. Rather LJ, et al. Dyes Pigments. 2023;210:110989. https://doi.org/10.1016/j.dyepig.2022.110989














