Investigadores desarrollaron dos tecnologías para lograr su fosforilación, con propiedades funcionales y nutricionales semejantes a la caseína bovina.
La capacidad de unión al calcio es esencial para la formación de micelas de caseína, las cuales son críticas para su funcionalidad en matrices alimentarias. Un desafío importante en la producción de caseínas en sistemas microbianos es su dependencia de modificaciones postraduccionales esenciales, en particular la fosforilación. Lograr el patrón correcto de fosforilación es un desafío significativo para la utilización de caseínas recombinantes en aplicaciones alimentarias, ya que resulta fundamental para su funcionalidad.
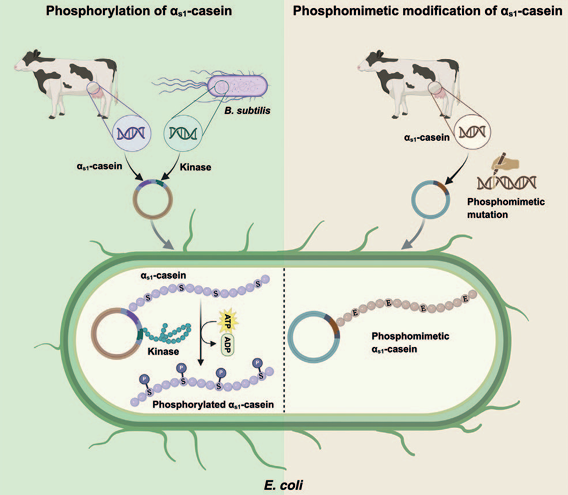
En un trabajo publicado en marzo en la revista Trends in Biotechnology (1), un grupo de investigadores comunicó la utilización con éxito de la coexpresión de quinasas bacterianas para fosforilar la αs1-caseína, imitando el patrón de fosforilación nativo. También desarrollaron una estrategia fosfomimética alternativa que permite evitar el requisito de fosforilación. Estas caseínas fueron evaluadas por su capacidad de unirse al calcio a escala de laboratorio. La espectrometría de masas y la electroforesis bidimensional en gel (2DE) confirmaron la fosforilación sitio-específica, mientras que los ensayos funcionales revelaron la capacidad de unión al calcio y la semejanza estructural, ofreciendo una base para la innovación en proteínas lácteas sin origen animal.
(1) Production of phosphorylated and functional αs1-casein in Escherichia coli. Suvasini Balasubramanian; Golnaz Mobasseri; Lei Shi; Carsten Jers; Kohler Julie Bonne Køhler; Adeline Boire; Claire Berton-Carabin; Ivan Mijakovic; Peter Ruhdal Jensen. Trends in Biotechnology, Month 2025, Vol. XX, No. XX. https://doi.org/10.1016/j.tibtech.2025.05.015
Las proteínas lácteas son una parte integral de la nutrición humana y presentan una variedad de propiedades funcionales que contribuyen de manera significativa al sabor, la textura y el aroma de diversos productos lácteos. Estas proteínas, clasificadas habitualmente como caseínas y proteínas de suero, son muy valoradas por su perfil nutricional y su biodisponibilidad, lo que las convierte en una fuente preferida de proteína tanto para lactantes como para adultos. De hecho, el mercado mundial de caseína fue valuado en USD 2.700 millones en 2023, con proyecciones que indican un crecimiento a una tasa compuesta anual del 6,3%, alcanzando los 4.900 millones de dólares en 2033.
En el caso de las caseínas, son especialmente valoradas en las industrias alimentaria y farmacéutica debido a su biocompatibilidad, versatilidad y propiedades funcionales. En aplicaciones alimentarias, contribuyen a la formación de espuma, la emulsificación y la estabilización; mientras que, en farmacéutica, sus propiedades de solubilidad, gelificación y capacidad de unión las hacen ideales para la formulación de fármacos. Además, las caseínas son un nutracéutico preferido tanto por deportistas como por personas con necesidades nutricionales específicas. No obstante, satisfacer la creciente demanda de productos a base de caseína requiere un aumento en la producción láctea, lo que agrava las preocupaciones ambientales y estimula el desarrollo de tecnologías alternativas de producción.

En este contexto, la fermentación de precisión y la agricultura celular ofrecen alternativas prometedoras para producir proteínas animales sostenibles. Los microorganismos se han utilizado desde hace tiempo como fábricas celulares en aplicaciones alimentarias y farmacéuticas, facilitando la producción de suplementos dietarios, enzimas y otras biomoléculas. Los avances en biotecnología han ampliado el repertorio de hospedadores microbianos más allá de los organismos modelo tradicionales, permitiendo la reingeniería de diversas especies microbianas para la producción de proteínas recombinantes. Esto ha llevado a la expresión exitosa, a escala comercial, de proteínas de suero mediante fermentación de precisión, las cuales ya se comercializan.
Sin embargo, lograr la producción funcional de caseínas a través de sistemas microbianos sigue siendo un desafío importante. Uno de los principales obstáculos es la necesidad de modificaciones postraduccionales (PTMs), en particular la fosforilación. Mientras que las proteínas de suero, especialmente la β-lactoglobulina, pueden expresarse de manera eficiente en hospedadores microbianos debido a la ausencia de PTMs como la fosforilación o la glicosilación, las caseínas requieren una fosforilación precisa para conservar sus propiedades funcionales, en especial su capacidad de unirse a fosfatos de calcio amorfos y formar micelas.
Para solucionarlo, los autores de la investigación proponen dos enfoques complementarios. La primera solución consiste en diseñar bacterias para coexpresar quinasas bacterianas, lo que da como resultado caseínas recombinantes con el patrón de fosforilación nativo y con propiedades funcionales. “Logramos fosforilar la αs1-caseína en Escherichia coli utilizando quinasas bacterianas, alcanzando la fosforilación en todos los sitios nativos”, afirman. Como complemento de este enfoque, desarrollaron también una estrategia fosfomimética mediante la sustitución de residuos de serina por aspartato para imitar la fosforilación. Esta caseína ofrece una alternativa viable y mantiene las propiedades funcionales.
La caracterización estructural y funcional de todas las αs1-caseínas recombinantes, tanto fosforiladas como fosfomiméticas, demostró propiedades comparables a las de la α-caseína bovina, incluidas la afinidad de unión al calcio, la digestibilidad y la integridad estructural. Cabe destacar que la αs1-caseína fosfomimética puede ofrecer un sistema más simple, mientras que la caseína fosforilada se asemeja más estrechamente a la caseína bovina. Tanto las caseínas fosforiladas como las fosfomiméticas mostraron una capacidad de unión al calcio significativamente mayor en comparación con las caseínas no fosforiladas.
Este enfoque tiene implicaciones significativas para el desarrollo de fuentes alternativas de proteínas, respondiendo tanto a las demandas de sostenibilidad como a las funcionales en la industria alimentaria. Las caseínas obtenidas mostraron estructura, digestibilidad y capacidad de unión al calcio muy similares a las de origen bovino. Esto abre la puerta a la elaboración de quesos, yogures y otros alimentos con las propiedades de los lácteos tradicionales, pero producidos mediante procesos innovadores que pueden contribuir a la sustentabilidad del sistema alimentario global. Si bien todavía quedan pasos para avanzar en su desarrollo a escala industrial, este trabajo muestra cómo la ciencia y la biotecnología pueden contribuir a diversificar las formas de producción de proteínas, complementando a los sistemas actuales y ofreciendo nuevas opciones para la alimentación del futuro.














