Teresa María López-Díaz1,2,*,Ángel Alegría 1, José María Rodríguez-Calleja1,2, Patricia Combarros-Fuertes1,2, José María Fresno1,2, Jesús A. Santos1,2, Ana Belén Flórez3,4 y Baltasar Mayo3,4
1Departamento de Higiene y Tecnología de los Alimentos – Facultad de Veterinaria – Universidad de León. León, España.
2Instituto de Ciencia y Tecnología de los Alimentos – Universidad de León. León, España.
3Departamento de Microbiología y Bioquímica – Instituto de Investigación Láctea de Asturias – Consejo Superior de Investigaciones Científicas –IPLA-CSIC. Villaviciosa, España.
4Instituto de Investigaciones Sanitarias del Principado de Asturias – ISPA. Oviedo, España.
Resumen
Los quesos azules son aquellos cuya matriz está veteada con un color azul, gris azulado o azul verdoso debido al desarrollo de Penicillium roqueforti. Existen más de 45 variedades de queso azul producidas en todo el mundo, con algunas características distintivas, aunque el proceso de fabricación es similar. Además de P. roqueforti, poblaciones microbianas complejas interactúan y se suceden a lo largo de la fabricación y maduración en la superficie (corteza) y en el interior (matriz) del queso. La microbiota de los quesos azules está formada por una amplia gama de microorganismos procariotas y eucariotas. La acidificación de la cuajada se basa en la acción de los lactococos y otras especies de bacterias lácticas (BAL). La calidad final y las propiedades de conservación de los quesos madurados dependen en gran medida de los sistemas enzimáticos de los componentes de la microbiota, en particular de los de las especies de BAL, P. roqueforti y levaduras. La proteólisis es el proceso bioquímico primario más complejo e importante que interviene en los quesos de vetas azules durante la maduración, siendo considerado P. roqueforti el principal agente proteolítico. La lipólisis también es fuerte y origina, entre otros compuestos, las cetonas, que son los principales compuestos aromáticos de los quesos de vetas azules. Además, durante la maduración se producen varios compuestos bioactivos. Las actividades bioquímicas, principalmente de origen microbiano, son las responsables de las características sensoriales de estas variedades de queso tan apreciadas en todo el mundo.
Palabras clave: quesos azules; Penicillium roqueforti; micotoxinas; proteólisis; lipólisis; microbiota del queso
1- Introducción
Los quesos azules (quesos veteados de azul) se caracterizan por la presencia de vetas azules en su interior debido al desarrollo del hongo Penicillium roqueforti (presente de forma natural o añadido como cultivo secundario). El primer queso azul descrito fue el Gorgonzola (Italia, siglo IX), seguido del Roquefort (siglo XI), aunque hay algunos relatos que sitúan al queso francés en el siglo VIII [1]. Las otras variedades se describieron por primera vez a partir del siglo XVII [2]. Los quesos azules son quesos semiduros, con un peso muy variable según el tipo (de 0,3 a más de 10 kg), una materia seca fresca del 50-60%, un contenido de grasa del 30-40%, un contenido de proteínas del 20-30% y un contenido variable de NaCl (más comúnmente, 3-4%) [1]. La fabricación de queso azul tiene como puntos diferenciales los siguientes: adición de esporas de P. roqueforti (opcional); adición de cultivos lácticos heterofermentativos (Leuconostoc spp., opcional, ver sección 3.3); corte de la cuajada en trozos pequeños (para crear una pasta abierta); secado o, con menos frecuencia, salado en salmuera; con perforaciones (permite la entrada de aire, lo que activa el crecimiento de P. roqueforti y el desarrollo de las vetas azules; opcional) y maduración a unos 10°C, y 85-95% de humedad (para algunas variedades, en cuevas naturales), durante al menos 1-2 meses) [1,2,3,4].
2 – Tipos de queso azul
En todo el mundo se producen más de 45 variedades de queso azul (https://en.wikipedia.org/wiki/List_of_blue_cheeses, consultado el 1 de mayo de 2023). De ellos, los más conocidos son los elaborados en Europa (Roquefort, Cabrales, Stilton, Gorgonzola y Danablu), todos ellos con Denominación de Origen Protegida (DOP) o Indicación Geográfica Protegida (IGP) (Tabla 1). Aparte de estas, España produce otras variedades, como Valdeón (IGP), Picón-Bejes Tresviso (DOP) y Gamonedo (DOP), todas ellas en la Cordillera de los Picos de Europa (en el norte), y Francia el Bleu d’Auvergne (DOP) o el Bleu de Bresse, entre otras 14 variedades.
Los quesos azules pueden elaborarse con leche cruda o pasteurizada (en algunas ocasiones, termizada, Danablu) procedente de vaca, oveja o cabra, o una mezcla de ellas, aunque en todo el mundo la leche de vaca es la más habitual. Por ejemplo, en Francia la mayoría de los quesos azules se elaboran con leche de vaca, excepto el Roquefort, y en España y Grecia es habitual añadir leche de oveja a la leche de vaca. En cuanto al uso de leche cruda, en algunas variedades es obligatoria según la DOP (i.e., Cabrales o Roquefort) (Tabla 1) [1,2,3,4].
3 – Microbiología
La microbiota del queso azul es compleja, sobre todo cuando se utiliza leche cruda. Las bacterias lácticas (BAL) y los hongos dominan el proceso. Entre los primeros, aparte de Lactococcus spp., suele estar presente Leuconostoc, que favorece una textura abierta. Entre los hongos, aparte de P. roqueforti, suelen estar presentes diferentes levaduras. Todos ellos contribuyen a las características del producto final.
3.1 – Factores ecológicos
Los factores ecológicos que influyen en la microbiota del queso son variables en cierta medida, en función de la variedad de queso azul. El pH aumenta durante la maduración, de 4,7-5,0 (primeros días de fabricación) a 6,0-7,0 al final de la maduración (el pH en el interior aumenta más rápidamente que en la superficie). Este aumento se debe a la degradación del ácido láctico por mohos no BAL (P. roqueforti) y levaduras y proteólisis. La actividad del agua disminuye rápidamente durante la primera semana y lentamente en el resto de la fabricación, terminando en 0,91-0,94. En cuanto al contenido de cloruro de sodio, el rango en el producto final es del 2 al 5% (lo más común es del 3 al 4%) [1,2]. El pH y la sal en gradientes de humedad y baja temperatura son las coordenadas fisicoquímicas que impulsan el desarrollo de las microbiotas secundarias y guían las actividades enzimáticas necesarias para una maduración adecuada.
3.2 – Microbiota del queso azul
El queso azul se puede fabricar en diferentes tamaños y formas utilizando leche de diferentes especies de mamíferos (o mezclas) y siguiendo diferentes tecnologías de fabricación y maduración [5]. El tipo de leche y la tecnología de procesamiento influyen en gran medida en la microbiota del queso durante las mencionadas etapas y por lo tanto en sus atributos sensoriales finales. La mayoría de los quesos azules tradicionales (por ejemplo, Roquefort, Gorgonzola, Cabrales, Gamonedo, etc.) todavía se fabrican con leche cruda siguiendo las tecnologías artesanales tradicionales. Por lo tanto, no es sorprendente la gran diversidad de poblaciones microbianas junto con los diferentes perfiles de aroma y sabor. Para la estandarización, actualmente se están agregando cepas de BAL mesófilas (Lactococcus lactis, Lc. cremoris y Leuconostoc spp.) como iniciadores para quesos elaborados con leche cruda y pasteurizados [1]. Como excepción, los iniciadores de Gorgonzola son mezclas de especies BAL mesófilas (como las anteriores) y termófilas (Streptococcus thermophilus y Lactobacillus delbrueckii) [6]. Tradicionalmente, los quesos tampoco se inoculaban con esporas de P. roqueforti. Se contaminaban naturalmente con este hongo de los entornos de fabricación y maduración. Sin embargo, la adición de esporas comerciales es una práctica común, tanto a escala de fabricación artesanal como industrial (Tabla 1). Otros factores que afectan a la microbiota son la salazón de los quesos mediante la aplicación de sal gruesa sobre la superficie o mediante la molienda y mezcla de la cuajada con sal antes del moldeo [1], o la inmersión en salmuera, así como la maduración del queso azul a bajas temperaturas (8-12 °C) y alta humedad relativa (>90%). Por último, los quesos se perforan con frecuencia para facilitar la entrada de aire y permitir un desarrollo uniforme de P. roqueforti en la matriz, lo que contribuye al aspecto visual típico en el corte.
3.2.1 – Técnicas microbiológicas
Los métodos de cultivo se han utilizado ampliamente para la caracterización de la diversidad y sucesión de las poblaciones microbianas a lo largo de la fabricación y maduración del queso antes del advenimiento de las técnicas independientes de cultivo molecular en microbiología de los alimentos. Entre estas últimas técnicas, la electroforesis de gradiente de temperatura temporal (TTGE) y la electroforesis en gel de gradiente desnaturalizante (DGGE) y otras se han aplicado ampliamente para estudiar la evolución espacial y temporal de las comunidades procariotas y eucariotas en varios tipos de queso azul, incluidos Bleu d’Auvergne, Cabrales, Gorgonzola y Stilton (Tabla 1). Más recientemente, la aplicación de técnicas de secuenciación de alto rendimiento (HTS) ha ampliado los biotipos bacterianos y fúngicos detectados tanto en la superficie como en el interior de muchas variedades de queso [25,26].
Tabla 1 – Principales propiedades de los quesos europeos tradicionales de vetas azules y de las principales poblaciones microbianas identificadas mediante técnicas dependientes e independientes del cultivo.
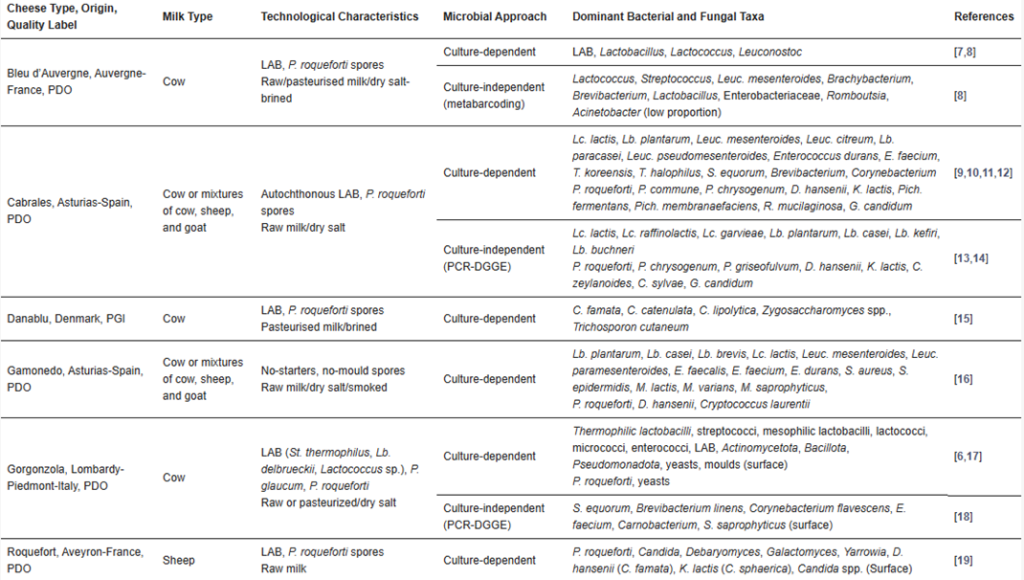
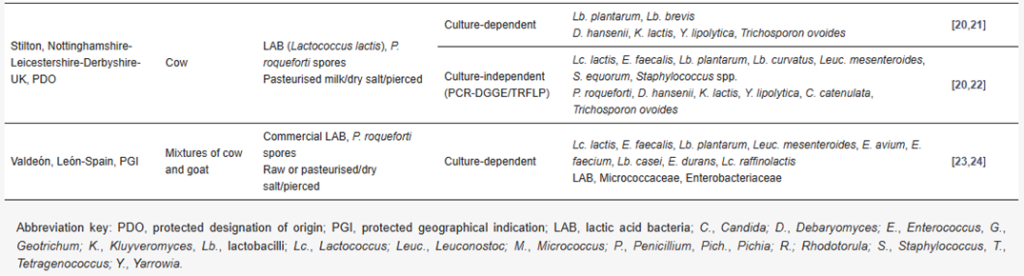
3.2.2 – Diversidad y sucesión microbiana en los quesos azules
La fabricación de la mayoría de los quesos azules tradicionales a partir de leche cruda asegura una alta diversidad microbiana, incluso mayor si se emplean procesos de premaduración [5]. Como en muchos otros tipos de quesos, el análisis microbiano de los quesos azules se ha dirigido a la búsqueda y selección de cultivos acidificantes (BAL) y de maduración (P. roqueforti) [10,13,15,16,20,24]. Como resultado de la fabricación artesanal, donde las condiciones ambientales no controladas son comunes, se han reportado grandes diferencias microbianas entre lotes, productores y temporadas [13,14,27].
- Poblaciones bacterianas
Lc. lactis y Lc. cremoris, que alcanzan densidades celulares de hasta 109 ufc/g de queso, se encargan de la acidificación de la cuajada; sus poblaciones disminuyen lentamente durante la maduración. Otras BAL involucradas incluyen varias especies de lactobacilos como Lactiplantibacillus plantarum, Lacticaseibacillus paracasei y otras especies homo y heterofermentativas mesófilas (p. ej., Levilactobacillus brevis, Latilactobacillus curvatus) que se desarrollan lentamente, aunque pueden superar a los lactococos después de 15 a 30 días de maduración. Los Leuconostoc productores de dextrano (Leuc. mesenteroides, Leuc. citreum y Leuc. pseudomesenteroides) se encuentran con frecuencia en menor número. Entre otras poblaciones de BAL los recuentos de medios selectivos de Enterococcus- y estreptococos/micrococos suelen ser altos; estos incluyen E. faecalis, E. faecium y especies de Streptococcus y Staphylococcus (Tabla 1). Más recientemente, el uso de nuevas técnicas de cultivo ha permitido la recuperación, como parte de la microbiota dominante, de nuevas especies bacterianas, como Tetragenococcus spp., Staphylococcus equorum y especies de los géneros Brevibacterium y Corynebacterium [datos no publicados].
Además de las bacterias recuperadas en cultivo, las técnicas DGGE y TTGE permiten la detección de tipos bacterianos no convencionales más allá de los recuperados mediante cultivo, incluyendo entre otras especies de BAL Lc. garvieae y Lc. Raffinolactis; St. thermophilus [14,27]; y otros de los géneros Sphingobacterium, Mycetocola, Brevundimonas, etc. [28].
- Levaduras y mohos
P. roqueforti es el agente de maduración fundamental de los quesos azules y es responsable del aspecto visual, así como de los perfiles de textura, sabor y aroma [29]. Sin embargo, particularmente en los quesos elaborados con leche cruda, un gran número de especies de levaduras pueden crecer acompañando a P. roqueforti y otros hongos; todos juntos componen la microbiota del queso azul. A partir de pequeñas cantidades en la leche, las levaduras alcanzan poblaciones mayoritarias durante la maduración (hasta 108 UFC/G) [30]. Tanto P. roqueforti como las levaduras poseen potentes sistemas proteolíticos y lipolíticos que ayudan a transformar los componentes de la leche en compuestos aromáticos. De hecho, se han propuesto cepas de levadura seleccionadas como cultivos adjuntos y de maduración para ciertos quesos azules [10,15]. Geotrichum candidum (estado teleomorfo de Galactomyces candidus) es una de las especies de levadura dominantes en la superficie e interior de los quesos. G. candidum produce varias enzimas para la descomposición de proteínas y grasas, lo que da como resultado compuestos aromáticos clave [31]. Además de G. candidum, Debaryomyces hansenii, Kluyveromyces lactis, Pichia spp., Rhodotorula spp., Zygosaccharomyces spp. y Saccharomyces spp. han sido aislados e identificados en diferente número a partir de distintas variedades (Tabla 1). La microbiota de los quesos azules merece una caracterización más detallada, ya que puede representar una fuente de nuevas especies [32].
Los quesos de vetas azules pertenecen a una categoría de quesos especiales que se distinguen de todos los demás por sus perfiles visuales, de sabor y de aroma. Se cree que la calidad general del queso azul es el resultado de la acción concertada de todos los miembros de la microbiota que, como revela el uso de técnicas moleculares de cultivo e independientes del cultivo de última generación, está formada por una impresionante diversidad de especies bacterianas y fúngicas.
3.3. Cultivos lácticos
En la producción de quesos de vetas azules, la acidificación natural de las bacterias lácticas (BAL) ha sido sustituida por la adición deliberada de cultivos iniciadores seleccionados. Estos cultivos primarios de BAL deben ser capaces de reducir el pH de la leche y sobrevivir al ataque de los fagos. Por lo tanto, las principales mezclas iniciadoras disponibles comercialmente para el queso azul contienen una mezcla de cepas pertenecientes al género Lactococcus. La mayoría de los tipos de queso azul requieren un cultivo iniciador mesófilo, que generalmente contiene cepas de Lc. lactis, subespecies lactis y Lc. cremoris. Estas bacterias también contribuyen a las propiedades organolépticas del queso, generando compuestos de sabor, ya sea directamente por el metabolismo celular o indirectamente por la liberación de enzimas. Las cepas de Lc. lactis, subsp. lactis biovar diacetylactis, se incluyen con frecuencia en cultivos iniciadores mesófilos, ya que este microorganismo es capaz de catabolilizar el citrato a dióxido de carbono y el compuesto de sabor diacetilo, lo que le da al queso un sabor mantecoso distintivo [33].
También se agregan cepas de Leuc. mesenteroides subsp. cremoris debido a su capacidad para producir sabor (diacetilo), pero principalmente debido a su producción de CO2, que rompe la estructura de la cuajada, ayudando al desarrollo del moho Penicillium dentro del queso [34]. En aquellos quesos azules en los que el calentamiento de la leche y la cuajada forma parte del proceso de elaboración, se puede añadir una mezcla de iniciadores mesófilos y termófilos. Estos iniciadores contienen mezclas de las cepas mencionadas y pequeñas cantidades de St. thermophilus y Lb. delbruecki subsp. bulgaricus [1].
3.4. Penicillium roqueforti y otros cultivos adjuntos
P. roqueforti es el microorganismo más importante que interviene en la fabricación del queso azul. Pertenece al subgénero Penicillium (caracterizado por ter-/quaterverticillata conidiophorus); las colonias crecen rápidamente (40-70 mm de diámetro en 7 d, un rasgo característico), planas o ligeramente surcadas radialmente, bajas y velutinosas; las paredes conidióforas son muy rugosas [35]. Según Frisvad y Filtenborg [36], existen dos variedades, siendo P. roqueforti var. roqueforti la que se utiliza en la fabricación de quesos. Además, utilizando herramientas moleculares [37] se propusieron tres especies que fueron confirmadas posteriormente [38]: P. roqueforti, P. carneum y P. paneum.
P. roqueforti parece tener los requerimientos de oxígeno más bajos para el crecimiento de todos los Penicillium [35], lo que, junto con otras características fisiológicas como la estimulación salina [39,40] y la capacidad de crecer a bajas temperaturas [41], explicarían su presencia (incluso natural) en el interior del queso azul. Por otro lado, esta especie, al igual que muchas otras especies de Penicillium, produce varias micotoxinas (ver Sección 3.5).
Las características únicas de estos quesos se deben, en gran medida, al crecimiento de P. roqueforti. El sabor del producto final se debe principalmente a las actividades lipolíticas y proteolíticas de este hongo [41]. Penicillium es el principal hongo responsable de la degradación de los lípidos en esta variedad de queso [6,42], con una amplia variedad de compuestos aromáticos volátiles y no volátiles producidos principalmente por P. roqueforti. Esta especie también se considera el principal origen de las enzimas responsables de la proteólisis en el queso azul [42]. Además, el aspecto del queso está definido por las vetas azules producidas por P. roqueforti en el interior de la pasta. Por último, esta especie participa en el consumo de ácido láctico y en la neutralización del queso [43].
Durante muchos años, la fabricación de quesos azules se ha llevado a cabo de forma totalmente natural. Sin embargo, hoy en día la fabricación en condiciones controladas y el uso de cepas seleccionadas de P. roqueforti son prácticas comunes en la industria quesera y se consideran necesarias para obtener un producto con las características deseadas. Para la selección de las cepas se evalúan varias propiedades tecnológicas: actividades proteolíticas y lipolíticas, color, tasa de germinación y crecimiento a las temperaturas de maduración, tolerancia a la sal y micotoxigenicidad (ver Sección 3.5). La actividad proteolítica de la cepa es extremadamente importante para el desarrollo de la textura, mientras que la capacidad lipolítica es esencial para el desarrollo del aroma [1]. Si la proteólisis no es suficiente, el queso quedará seco y duro, mientras que, si está en exceso, puede quedar demasiado blando. Además, la lipólisis alta está relacionada con un sabor más intenso (ver Sección 5). Esto es considerado por las empresas que ofrecen cepas con diferentes propiedades. Suspensiones de esporas (mín. 1010/mL) de P. roqueforti puede añadirse a la leche, a la cuajada o durante el moldeado.
En cuanto a otros iniciadores complementarios, las levaduras, como se mencionó en la sección 3.2, forman parte de la microbiota natural y pueden desempeñar un papel en la fabricación de quesos azules. Entre la lista de especies encontradas en esta variedad (más de 20), las que podrían ser utilizadas como potenciales cultivos adjuntos son D. hansenii, Yarrowia lipolytica y Sac. cerevisiae, siendo la primera la especie más frecuentemente aislada en el queso azul [1]. D. hansenii se ha encontrado en nuestros laboratorios, junto con otras levaduras como Y. lipolytica, en varios quesos azules españoles (queso artesanal de Valdeón [44]; Cabrales [10]). En cuanto a Y. lipolytica, parece un buen candidato para ser utilizado en la fabricación de queso azul de acuerdo con su capacidad para crecer y competir con otras levaduras naturales como D. hansenii y S. cerevisiae, a su compatibilidad y posible estimulación de BAL cuando se inoculan conjuntamente y a sus notables actividades lipolíticas y proteolíticas [1].
3.5. Producción potencial de micotoxinas
P. roqueforti puede producir una variedad de micotoxinas (metabolitos secundarios tóxicos) como la toxina PR, el ácido micofenólico y las roquefotinas, entre otras [35,45], y algunas de ellas se han encontrado en quesos azules comerciales en concentraciones muy bajas. Teniendo en cuenta este hecho, la toxicidad relativamente baja de las micotoxinas y la inestabilidad de algunas de ellas (toxina PR y ácido penicílico) significa que incluso un gran consumo de queso azul no representa un riesgo para la salud del consumidor [1,46,47,48]. Sin embargo, la selección de cepas que se utilizarán en la fabricación de queso debe incluir una evaluación de micotoxinas para garantizar el uso de aquellas con la micotogenicidad más baja.
3.6. Patógenos y deterioro en quesos azules
3.6.1. Microorganismos patógenos
A pesar del enorme consumo mundial de queso, el queso azul y los quesos madurados en general son razonablemente seguros. Así, sólo se encontraron 152 notificaciones relacionadas con quesos con un nivel de riesgo “grave” o “potencialmente grave” en el portal RASFF (Sistema de Alerta Rápida para Piensos y Alimentos) (https://webgate.ec.europa.eu/rasff-window/screen/search, consultado el 1 de mayo de 2023); la mayoría de ellos (144 notificaciones) se asociaron con microorganismos patógenos, principalmente Listeria monocytogenes, algunos serovares de Salmonella y Escherichia coli productora de toxina Shiga.
Los criterios microbiológicos establecidos en la normativa de la UE establecen la ausencia de Salmonella en 25 g de quesos (incluidos los quesos de vetas azules) procedentes de leche cruda o leche sometida a un tratamiento térmico inferior al de la pasteurización, así como el seguimiento de Listeria monocytogenes en la categoría de “alimentos listos para el consumo incapaces de favorecer el crecimiento de L. monocytogenes distintos de los destinados a lactantes y a usos médicos especiales”, teniendo en cuenta las propiedades fisicoquímicas de los quesos azules [49].
Se han notificado pocos brotes relacionados con quesos azules (Tabla 2). El primer incidente reportado estuvo asociado con el queso Stilton producido en una pequeña cooperativa lechera en Inglaterra. Produjo 36 brotes de enfermedades gastrointestinales que involucraron 155 casos, y los síntomas eran sugestivos de intoxicación alimentaria estafilocócica, pero las pruebas de laboratorio de los quesos implicados en varios de los incidentes no detectaron ninguna toxina o sustancia química, y una sola cepa de Staphylococcus aureus que produjo enterotoxina D se aisló de una muestra sospechosa después del enriquecimiento [50]. Otro brote fue causado por norovirus, el vehículo alimenticio era un aderezo pasteurizado de queso azul, por lo que se atribuyó a deficiencias en las prácticas de manipulación de alimentos y en la higiene del personal [51]. Un brote multiestatal se debió a la contaminación con L. monocytogenes, que afectó a 15 pacientes [52]. Los quesos madurados con moho son extremadamente susceptibles a la contaminación de la superficie durante el proceso de maduración [53], y L. monocytogenes se asocia regularmente con cortezas de queso en quesos azules [54,55], habiendo sido implicado en un caso de listeriosis en Italia [56]. Un brote debido a Escherichia coli O157:H7 tuvo lugar en Escocia en el verano de 2016. El brote ocurrió en dos fases y fue ligado al consumo de un tipo particular de queso azul artesanal (queso Dunsyre); La mayoría de los pacientes de la primera fase del brote declararon haber comido en un hotel donde se servía este queso en particular. La segunda fase se relacionó con un entorno de cuidado infantil, probablemente debido a la introducción de la bacteria por parte de un individuo infectado no identificado, con la posterior propagación al grupo infantil a través de la contaminación ambiental. Se registraron un total de 26 casos confirmados, de los cuales 17 requirieron hospitalización. Dos casos desarrollaron SUH, uno de los cuales, un niño de tres años, murió [57].
Tabla 2 – Reportes de patógenos asociados con consumo de queso azul.
| Agente | Alimento vehículo | Año | Enfermedades | Hospitalizaciones/Muertes | Referencias |
| Desconocido (sospecha de intoxicación alimentaria por estafilococos | Queso Stilton (leche sin pasteurizar) | 1989 | 155 | 1/0 | [50] |
| Genogrupo II de norovirus | Aderezo de queso azul (pasteurizado) | 2011 | 3 | 0/0 | [52] |
| L. monocytogenes | Queso de vetas azules (leche sin pasteurizar) | 2011 | 15 | 1/1 | [52] |
| E. coli O157:H7 | Queso azul Dunsyre (leche sin pasteurizar) | 2016 | 26 | 17/1 | [57] |
Otros riesgos microbiológicos asociados a los quesos madurados son la presencia de sustancias tóxicas producidas por microorganismos, como aminas biógenas y micotoxinas. Las aminas biógenas se pueden encontrar en los quesos azules a través de la proteólisis que tiene lugar en el queso (ver sección 4) debido a la actividad microbiana [58,59], lo que afecta a la calidad del producto final. El consumo de alimentos que contienen mayores cantidades de aminas biógenas tóxicas puede causar intoxicación alimentaria. En términos de seguridad alimentaria, las más importantes son la histamina y la tiramina. La Comisión Técnica BIOHAZ de la EFSA [60] llevó a cabo una evaluación cualitativa del riesgo de las aminas biógenas (histamina, tiramina, cadaverina y putrescina) en alimentos fermentados. El informe incluyó quesos madurados en las principales categorías de alimentos que contienen aminas biógenas.
3.6.2. Deterioro
En la Tabla 3 se muestra una lista de los agentes de deterioro comunes de los quesos azules. Una microbiota de deterioro puede contaminar y crecer fácilmente en la superficie de los quesos azules, contrarrestando la actividad de los fermentos microbianos (P. roqueforti y BAL). Este hecho puede causar cambios indeseables en los quesos, como sabores desagradables o pérdida de color típico por parte de otras especies de Penicillium. Entre ellos, P. caseifulvum se ha detectado con frecuencia en quesos azules e instalaciones de elaboración de quesos y se ha relacionado con la decoloración del queso [61].
Tabla 3 – Agentes de descomposición comunes del queso azul
| Agente | Efecto | Defecto del queso | Control |
| Pseudomonas spp. | Multiplicación microbiana | limo; sabores desagradables | higiene general; control de temperatura; embalaje adecuado |
| Bacterias lácticas | Multiplicación microbiana /producción de ácido en exceso | acidez | higiene general; control de temperatura; |
| Levaduras | Multiplicación microbiana | sabores desagradables; cambios de color (marrón) | higiene general; control de temperatura; embalaje adecuado |
| Mohos | Multiplicación microbiana | cambios en el color/sabor | higiene general; control de temperatura; control de maduración |
| Ácaros | Proliferación de ácaros en la superficie | Mala apariencia | higiene general; protocolos adecuados de limpieza/desinfección |
Cabe señalar que también se ha informado que G. candidum contribuye a la maduración del queso y, a veces, causa una interacción negativa al inhibir P. roqueforti utilizado como cultivo iniciador [1]. Otra causa biológica del deterioro del queso azul es la presencia de ácaros del género Tyrophagus. Los ácaros se desarrollan en la superficie, probablemente comiendo los hongos y causando pérdidas económicas, así como problemas de salud (alergias, transmisión de microorganismos e incluso un reservorio de priones) [62].
4. Proteólisis y lipólisis
La proteólisis es el proceso bioquímico primario más complejo e importante involucrado en los quesos azules durante la maduración [63]. Contribuye al ablandamiento de la textura del queso a través de la hidrólisis de la matriz proteica y a la disminución de su aw. Además, tiene un efecto directo sobre el sabor a través de la producción de pequeños péptidos y aminoácidos [64]. En los quesos de vetas azules, varios agentes son responsables de la proteólisis extensa: proteinasas liberadas por bacterias lácticas de cultivo iniciador (SLAB) y bacterias lácticas no iniciadoras (NSLAB); cuajo; proteinasas nativas de la leche y, especialmente, proteinasas y exopeptidasas y endopeptidasas producidas por P. roqueforti [65]. Las BAL son débilmente proteolíticas, aunque poseen un sistema proteinasa/peptidasa muy extenso con potencial para hidrolizar oligopéptidos a pequeños péptidos y aminoácidos [66].
La catepsina D y la quimosina producen el glicomacropéptido κ-CN (f106-169) después de la escisión del enlace Phe105-Met106. Del mismo modo, tienen actividades similares en la αs1-caseína, pero hidrolizan la αs2-caseína de manera muy diferente [66]. Más importante es la actividad proteolítica de la plasmina en los quesos azules, ya que los valores de pH establecidos durante la maduración son cercanos a los óptimos para su actividad, liberando diferentes péptidos [67].
P. roqueforti secreta aspartil y metaloproteinasas que han sido bien caracterizadas, incluyendo su especificidad en αs1- y β-caseínas [66]. Además, P. roqueforti posee varias exopeptidasas capaces de escindir los péptidos formados y una carboxipeptidasa de ácido extracelular que libera aminoácidos. Aunque la actividad proteolítica de P. roqueforti varía mucho entre cepas [68], se considera el principal agente proteolítico en todos los quesos azules.
La proteólisis extensa que tiene lugar en los quesos azules está determinada por el alto porcentaje de nitrógeno soluble pH 4.6 (pH4.6-SN) que oscila entre 32.8 y 69.2% [8,24,69]. El ligero aumento de esta fracción al inicio de la maduración se debe principalmente a la actividad proteolítica de la quimosina, favorecida por el bajo pH y el alto contenido de humedad del queso. Posteriormente, después de la esporulación de P. roqueforti, sus proteinasas extracelulares contribuyen al rápido aumento del pH 4.6-SN. Por otro lado, alrededor del 77 al 88% del pH 4.6-SN se solubiliza en ácido tricloroacético (TCA), mostrando una proteólisis más profunda [24,65,70]. Sin embargo, existen excepciones, como el queso Strachitunt, que presentó valores inferiores al 17% de pH4.6-SN/TN y al 11% de TCA-SN/TN [71] asociados a un retraso en la etapa de perforación del queso.
Al final de la maduración del queso azul, se reporta una alta degradación de la αs1- y la β-caseína, quedando sólo una pequeña parte intacta [63,65]. La αs1-caseína se degrada en primer lugar por la acción del cuajo sobre la αs1-I-CN, que, a medida que avanza la maduración, es un sustrato para otras enzimas, principalmente la aspartilproteasa de P. roqueforti o la quimosina [24,72].
Durante la proteólisis, se liberan péptidos que han atraído especial interés en función de sus propiedades fisiológicas en los organismos. Estos fragmentos de proteínas bioactivas muestran actividades antimicrobianas, antioxidantes, antitrombóticas, antihipertensivas, inmunomoduladoras, opioides y antiproliferativas [73]. Los estudios de estos compuestos en los quesos azules son escasos, a excepción del queso de Valdeón, que ha sido estudiado previamente [74]. Este estudio mostró la presencia de algunos péptidos inhibidores de la ACE y opioides. Asimismo, se observó que después de la simulación gastrointestinal, se encontró un mayor número de péptidos bioactivos, entre los que se encuentran péptidos antihipertensivos, antioxidantes, secretores de mucina intestinal y antibacterianos.
El incremento en la concentración de aminoácidos libres (FAA) durante la maduración se utiliza como un índice objetivo de maduración. Diferentes estudios han reportado valores de 10,11 mg/g en queso de Valdeón [70], 25,01 mg/g en queso Gorgonzola [65], 47,69 mg/g en queso de Cabrales [75] y 57,32 mg/g en queso Picón Bejes-Tresviso [76]. El alto contenido de FAA se ha atribuido a la actividad aminopeptidasa de P. roqueforti. El ácido glutámico, la leucina, la valina, la lisina y la fenilalanina predominan en los quesos de vetas azules, aunque también se detectan tirosina, serina y prolina en cantidades significativas [65,70,72,75,76]. La presencia de ácido γ-aminobutírico (GABA), producto de la descarboxilación del ácido glutámico, ha sido poco estudiada en quesos azules. Algunos estudios de Redruello et al. [77] han reportado concentraciones entre 1000 y 4000 mg GABA/kg en quesos Cabrales, Gamonedo y Picón Bejes-Tresviso, siendo muy superiores a las descritas para otros tipos de quesos madurados con bacterias. Este compuesto ha cobrado gran relevancia en los últimos años ya que presenta propiedades bioactivas con efectos beneficiosos para la salud [78].
Debido a la extensa y profunda proteólisis que tiene lugar en los quesos azules, el nivel de aminas biógenas es mayor que en otras variedades sin mohos. Las principales aminas biógenas en los quesos de veta azul son la tiramina, la cadaverina, la putrescina y la histamina [70,79].
Los lípidos del queso pueden sufrir degradación hidrolítica u oxidativa. Los cambios oxidativos son muy limitados debido al bajo potencial de oxidación-reducción (alrededor de −250 mV). En los quesos, la hidrólisis de los triglicéridos por lipasas con liberación de ácidos grasos (AGL) durante la maduración es más importante [64]. Al final de la maduración, los quesos azules muestran una concentración muy alta de AGL como resultado de una fuerte lipólisis, siendo variable en función según el tipo de queso: Picón Bejes-Tresviso con 58.355 mg/kg [76], Gamonedo con 75.685 mg/kg [16], Bleu d’Auvergne y Fourme D’Ambert con 86.000 y 30.000 mg/kg, respectivamente [80], y queso Valdeón IGP con 42.500 mg/kg [81].
Los principales ácidos grasos son los ácidos oleico (C18:1), palmítico (C16:0) y mirístico (C14:0) [76,80]. En algunos quesos, se observa una disminución en la concentración de AGL al final de la maduración, atribuida a su degradación a través de la vía oxidativa [82]. Los quesos producidos con cepas de P. roqueforti tuvieron una mayor abundancia de compuestos volátiles como metilcetonas y alcoholes secundarios [29]. Las cetonas son los principales compuestos aromáticos de los quesos azules, que representan entre el 50 y el 75% del perfil aromático total del roquefort, el Bleu des Causses y el Bleu d’Auvergne [83]; 47-55% en Gorgonzola [84]; y entre el 55 y el 75% en Stilton [85]. Los alcoholes primarios y secundarios son, después de las cetonas, los compuestos más importantes en el aroma de los quesos azules, representando más del 30% de los compuestos volátiles en Gorgonzola [84], del 10-30% en Stilton [85], y del 15-20% en Roquefort [83]. El alcohol se puede formar por reducción enzimática de metilcetonas utilizando Penicillium spp. [82]. Al final de la maduración, el 3-metil butanol es el alcohol predominante en los quesos azules, aunque también se han detectado altas concentraciones de 2-pentanol, 2-heptanol y 2-nonanol [86], responsables del aroma característico de los quesos azules. Por último, existen ésteres que contribuyen a atenuar el sabor picante típico de las metilcetonas [84]. Los ésteres etílicos junto con los ésteres metílicos son los compuestos predominantes [87], siendo el butanoato de etilo y el hexanoato de etilo los más destacados.
5. Características sensoriales
El color de la parte interna es blanco-amarillo claro (dependiendo del tipo de leche utilizada) con vetas de moho azul-verde distribuidas más o menos regularmente causadas por P. roqueforti (el color depende de la cepa utilizada). Las aberturas de los canales de perforación pueden ser visibles. Como se mencionó, es necesaria una textura abierta, con una cantidad mínima de oxígeno, para permitir el crecimiento de P. roqueforti. Otras características sensoriales son consecuencia de la intensa proteólisis y lipólisis que tiene lugar en su interior, como se ha indicado. La textura es más o menos suave, lisa y cremosa. En algunos tipos puede ser rebanable y untable, o puede desmoronarse cuando se corta. El olor suele ser intenso, agradable y penetrante. Las impresiones olfativas características se originan en las metilcetonas, introduciendo notas afrutadas, florales y especiadas. En las variedades ahumadas (Gamonedo, España), el aroma es ligeramente a humo. En cuanto al sabor, suele ser intenso y punzante, relativamente picante, salado y ácido. La corteza utilizada es natural, suave, fina, cremosa y con diferentes colores (marrón anaranjado, grisáceo, rojizo o amarillo) provocada por el crecimiento microbiano en la superficie. En Danablu es blanca y libre de crecimiento bacteriano o moho. En algunas variedades (Cabrales y Roquefort), el queso se envuelve con papel de aluminio cuando está listo para el consumo [3,4].
6. Conclusiones
Las características sensoriales de los quesos azules y, en definitiva, la esencia de estas variedades, se basan en complejas reacciones bioquímicas debidas en gran medida a una microbiota diversa en la que hongos y bacterias participan de forma activa. Aunque en los últimos años se han realizado estudios sobre la microbiología y la bioquímica de los quesos azules, es necesario seguir investigando, en particular en la caracterización de los quesos artesanales. Esto nos permitiría mantener la diversidad global de quesos azules existentes, lo que enriquece la amplia lista de variedades de quesos disponibles para el consumidor. Además, se necesita más investigación para dilucidar el papel de los compuestos bioactivos generados durante la maduración, como el GABA o los péptidos bioactivos, en la funcionalidad de estas variedades.
Financiación
La investigación en este ámbito ha contado con el apoyo de proyectos del Ministerio de Ciencia e Innovación (PID2019-110549RB-I00/AEI/10.13039/501100011033) y del Principado de Asturias (AYUD/2021/50916; AYUD/2021/57336).
Fuente: Trabajo publicado en revista Dairy 2023, 4(3), 410-422; https://doi.org/10.3390/dairy4030027
Referencias
- Cantor, D.M.; Van den Tempel, T.; Kronborg Hansen, T.; Ardö, Y. Queso azul. En Queso; Academic Press: Cambridge, MA, EE. UU., 2017; págs. 929-954. [Google Académico] [CrossRef]
- Mayo, B.; Alonso, L.; Alegría, A. Queso azul. En Manual de Queso en Salud: Producción, Nutrición y Ciencias Médicas; Preedy, V.R., Watson, R.R., Patel, V.B., Eds.; Wageningen Academic Publishers: Wageningen, Países Bajos, 2013; págs. 277-288. [Google Académico]
- López Morales, A.B.; Ardö, Y.; Berthier, F.; Karatzas, K.-A.G.; Bintsis, T. Quesos de vetas azules. En Tecnología Quesera Global: Calidad y Características del Queso; Papademas, P., Bintsis, T., Eds.; Wiley: Hoboken, Nueva Jersey, Estados Unidos, 2018; págs. 415-435. [Google Académico]
- Engelman, B.; Holler, P. Manual del Gourmet del Queso; Tandem Verlag GmbH: Rheinbreitbach, Alemania, 2008. [Google Académico]
- Ardö, Y. Queso de moho azul. En Enciclopedia de las Ciencias Lácteas, 3ª ed.; Academic Press: Cambridge, MA, EE. UU., 2022; págs. 30-35. [Google Académico] [CrossRef]
- Gobbetti, M.; Burzigotti, R.; Smacchi, E.; Corsetti, A.; De Angelis, M. Microbiología y bioquímica del queso Gorgonzola durante la maduración. Int. Lácteos J. 1997, 7, 519–529. [Google Académico] [CrossRef]
- Duval, P.; Chatelard-Chauvin, C.; Gayard, C.; Rifa, E.; Bouchard, P.; Hulin, S.; Picque, D.; Montel, M.C. Dinámica microbiana en quesos industriales de vetas azules en diferentes envases. Int. Lácteos J. 2016, 56, 198–207. [Google Académico] [CrossRef]
- Ferroukhi, I.; Bord, C.; Álvarez, S.; Fayolle, K.; Theil, S.; Lavigne, R.; Chassard, C.; Mardon, J. Cambios funcionales en el queso Bleu d’Auvergne durante la maduración. Químico de los alimentos. 2022, 397, 133850. [Google Académico] [CrossRef]
- Núñez, M. Microflora del queso de Cabrales: Cambios durante la maduración. J. Dairy Res. 1978, 45, 501-508. [Google Académico] [CrossRef]
- Álvarez-Martín, P.; Flórez, A.B.; López-Díaz, T.M.; Mayo, B. Identificación fenotípica y molecular de especies de levaduras asociadas al queso español de Cabrales de vetas azules. Int. Lácteos J. 2007, 17, 961–967. [Google Académico] [CrossRef]
- Flórez, A.B.; Álvarez-Martín, P.; López-Díaz, T.M.; Mayo, B. Identificación morfotípica y molecular de hongos filamentosos del queso español de Cabrales de vetas azules, y tipificación de aislados de Penicillium roqueforti y Geotrichum candidum. Int. Lácteos J. 2007, 17, 350–357. [Google Académico] [CrossRef]
- Rodríguez, J.; González-Guerra, A.; Vázquez, L.; Fernández-López, R.; Flórez, A.B.; de la Cruz, F.; Mayo, B. Aislamiento y caracterización fenotípica y genómica de Tetragenococcus spp. a partir de dos quesos tradicionales españoles de vetas azules elaborados con leche cruda. Int. J. Microbiol. Alimentos Microbiol. 2022, 371, 109670. [Google Académico] [CrossRef]
- Flórez, A.B.; López-Díaz, T.M.; Álvarez-Martín, P.; Mayo, B. Caracterización microbiana del queso tradicional español de Cabrales de vetas azules: Identificación de bacterias lácticas dominantes. Eur. Food Res. Technol. 2006, 223, 503–508. [Google Académico] [CrossRef]
- Flórez, A.B.; Mayo, B. Diversidad y sucesión microbiana durante la fabricación y maduración del queso tradicional español de Cabrales de vetas azules, según lo determinado por PCR-DGGE. Int. J. Microbiol. Alimentos Microbiol. 2006, 110, 165–171. [Google Académico] [Referencia cruzada] [PubMed]
- Tempel, T.V.D.; Jakobsen, M. Levaduras asociadas con Danablu. Int. Lácteos J. 1998, 8, 25–31. [Google Académico] [CrossRef]
- González de Llano, D.; Ramos, M.; Rodríguez, A.; Montilla, A.; Juárez, M. Características microbiológicas y fisicoquímicas del queso azul Gamonedo durante la maduración. Int. Lácteos J. 1992, 2, 121-135. [Google Académico] [CrossRef]
- Irlinger, F.; Layec, S.; Hélinck, S.; Dugat-Bony, E. Comunidades microbianas de la corteza del queso: diversidad, composición y origen. FEMS Microbiol. Lett. 2015, 362, 1–11. [Google Académico] [Referencia cruzada] [PubMed] [Versión Verde]
- Fontana, C.; Cappa, F.; Rebecchi, A.; Cocconcelli, P.S. Análisis de la microbiota superficial de los quesos italianos Taleggio, Gorgonzola, Casera, Scimudin y Formaggio di Fossa. Int. J. Microbiol. Alimentos Microbiol. 2010, 138, 205–211. [Google Académico] [CrossRef]
- Besançon, X.; Smet, C.; Chabalier, C.; Rivemale, M.; Reverbel, J.P.; Ratomahenina, R.; Galzy, P. Estudio de la flora de levaduras superficiales del queso Roquefort. Int. J. Microbiol. Alimentos Microbiol. 1992, 17, 9-18. [Google Académico] [Referencia cruzada] [PubMed]
- Gkatzionis, K.; Yunita, D.; Linforth, R.S.; Dickinson, M.; Dodd, C.E.R. Diversidad y actividades de levaduras de diferentes partes de un queso Stilton. Int. J. Microbiol. Alimentos Microbiol. 2014, 177, 109–116. [Google Académico] [CrossRef]
- Mugampoza, D.; Gkatzionis, K.; Swift, B.M.C.; Rees, C.E.D.; Dodd, C.E.R. La diversidad de especies de Lactobacillus del queso Stilton se relaciona con el sitio de aislamiento. Frente. Microbiol. 2020, 11, 904. [Google Académico] [CrossRef]
- Ercolini, D.; Hill, P.J.; Dodd, C.E.R. Estructura y ubicación de la comunidad bacteriana en el queso Stilton. Appl. Medio Ambiente. Microbiol. 2003, 69, 3540–3548. [Google Académico] [Referencia cruzada] [Versión Verde]
- López-Díaz, T.M.; Alonso, C.; Román, C.; García-López, M.L.; Moreno, B. Bacterias lácticas aisladas de un queso azul artesanal. Microbiol alimentario. 2000, 17, 23–32. [Google Académico] [CrossRef]
- Diezhandino, I.; Fernández, D.; González, L.; McSweeney, P.L.; Fresno, J.M. Cambios microbiológicos, físico-químicos y proteolíticos en un queso azul español durante la maduración (queso de Valdeón). Químico de los alimentos. 2015, 168, 134–141. [Google Académico] [CrossRef]
- Wolfe, B.E.; Botón, J.E.; Santarelli, M.; Dutton, R.J. Las comunidades de corteza de queso proporcionan sistemas manejables para estudios in situ e in vitro de la diversidad microbiana. Celda 2014, 158, 422–433. [Google Académico] [Referencia cruzada] [Versión Verde]
- Yeluri Jonnala, B.R.; McSweeney, P.L.H.; Sheehan, J.J.; Cotter, P.D. Secuenciación del microbioma del queso y su relevancia para la industria. Frente. Microbiol. 2018, 9, 1020. [Google Académico] [Referencia cruzada] [PubMed] [Versión Verde]
- Alegría, A.; González, R.; Díaz, M.; Mayo, B. Evaluación de la dinámica de las poblaciones microbianas en un queso azul mediante electroforesis en gel de gradiente de cultivo y desnaturalización. Curr. Microbiol. 2011, 62, 888–893. [Google Académico] [Referencia cruzada] [PubMed] [Versión Verde]
- Yunita, D.; Dodd, C.E.R. Dinámica de la comunidad microbiana de un queso de leche cruda con vetas azules del Reino Unido. J. Dairy Sci. 2018, 101, 4923–4935. [Google Académico] [Referencia cruzada] [PubMed]
- Caron, T.; Piver, M.L.; Péron, A.C.; Lieben, P.; Lavigne, R.; Brunel, S.; Roueyre, D.; Lugar, M.; Bonnarme, P.; Giraud, T.; et al. Fuerte efecto de las poblaciones de Penicillium roqueforti sobre compuestos volátiles y metabólicos responsables de aromas, sabor y textura en quesos azules. Int. J. Microbiol. Alimentos Microbiol. 2021, 354, 109174. [Google Académico] [Referencia cruzada] [PubMed]
- Roostita, R.; Flota, G.H. La presencia y crecimiento de levaduras en el Camembert y los quesos de vetas azules. Int. J. Microbiol. Alimentos Microbiol. 1996, 28, 393–404. [Google Académico] [Referencia cruzada] [PubMed]
- Boutrou, R.; Guéguen, M. Interests in Geotrichum candidum for cheese technology. Int. J. Food Microbiol. 2005, 102, 1–20. [Google Scholar] [CrossRef]
- Flórez, A.B.; Belloch, C.; Álvarez-Martín, P.; Querol, A.; Mayo, B. Candida cabralensis sp. nov., a yeast species isolated from traditional Spanish blue-veined Cabrales cheese. Int. J. Syst. Evol. Microbiol. 2010, 60, 2671–2674. [Google Scholar] [CrossRef][Green Version]
- Broome, M.C.; Powell, I.B.; Limsowtin, G.K.Y. Cheese Starter Cultures: Specific Properties. In Encyclopedia of Dairy Sciences, 2nd ed.; Fuquay, J.W., Ed.; Academic Press: Cambridge, MA, USA, 2011; pp. 559–566. [Google Scholar] [CrossRef]
- Alegría, Á.; Delgado, S.; Flórez, A.B.; Mayo, B. Identification, typing, and functional characterization of Leuconostoc spp. strains from traditional, starter-free cheeses. Dairy Sci. Technol. 2013, 93, 657–673. [Google Scholar] [CrossRef][Green Version]
- Pitt, J.I.; Hocking, A.D. Fungi and Food Spoilage, 4th ed.; Springer: New York, NY, USA, 2022. [Google Scholar]
- Frisvad, J.C.; Filtenborg, O. Terverticillate Penicillia: Chemotaxonomy and mycotoxin production. Mycologia 1989, 81, 837–861. [Google Scholar] [CrossRef]
- Boysen, M.; Skouboe, P.; Frisvad, J.; Rossen, L. Reclassification of the Penicillium roqueforti group into three species on the basis of molecular genetic and biochemical profiles. Microbiology 1996, 142, 541–549. [Google Scholar] [CrossRef][Green Version]
- Karlshoj, K.; Larsen, T.O. Differentiation of species from the Penicillium roqueforti group by volatile metabolite profiling. J. Agric. Food Chem. 2005, 53, 708–715. [Google Scholar] [CrossRef] [PubMed]
- Godinho, M.; Fox, P.F. Effect of NaCl on the germination and growth of P. roqueforti. Milchwissenschaft 1981, 36, 205–208. [Google Scholar]
- López-Díaz, T.M.; Santos, J.A.; Otero, A.; García, M.L.; Moreno, B. Some technological properties of Penicillium roqueforti strains isolated from a home-made blue cheese. Lett. Appl. Microbiol. 1996, 23, 5–8. [Google Scholar] [CrossRef]
- Moreau, C. Le Penicillium roqueforti, morphologie, physiologie, interêt en industrie fromagère, mycotoxines. Le Lait 1980, 60, 254–271. [Google Scholar] [CrossRef][Green Version]
- Coghill, D. The ripening of blue vein cheese: A review. Aust. J. Dairy Technol. 1979, 34, 72–75. [Google Scholar]
- Lenoir, J.; Lamberet, G.; Schmidt, J.L.; Tourneur, C. La main-dóuvre microbienne domine l’affinage del fromages. Rev. Laitiire Franfaise 1985, 444, 50–64. [Google Scholar]
- López-Díaz, T.M.; Santos, J.; Prieto, M.; García-López, M.L.; Otero, A. Mycoflora of a traditional Spanish blue cheese. Neth. Milk Dairy J. 1995, 49, 191–199. [Google Scholar]
- Samson, R.; Houbraken, J.; Thrane, U.; Frisvad, J.C.; Andersen, B. Food and Indoor Fungi, 2nd ed.; Westerdijk Fungal Biodiversity Institute: Utrecht, The Netherlands, 2019. [Google Scholar]
- Scott, P.M. Toxins of Penicillium species used in cheese manufacture. J. Food Prot. 1981, 44, 702–710. [Google Scholar] [CrossRef]
- Gripon, J.C. Mould-ripened cheeses. In Cheese: Chemistry, Physics and Microbiology; Major Cheese Groups; Fox, P.F., Ed.; Elsevier: London, UK, 1987; Volume 2, pp. 121–149. [Google Scholar]
- Engel, B.; Teuber, M. Toxic metabolites from fungal cheese starter cultures (Penicillium camemberti and Penicillium roqueforti). In Mycotoxins in Dairy Products; Van Egmond, H.P., Ed.; Elsevier Applied Science: Amsterdam, The Netherlands, 1989; pp. 163–192. [Google Scholar]
- European Commission. Regulation (EC) No 2073/2005 of the Commission of 15 November 2005 laying down microbiological criteria on food products. Off. J. Eur. Union 2005, 338, 1–26. Available online: http://data.europa.eu/eli/reg/2005/2073/oj (accessed on 25 April 2023).
- Maguire, H.C.F.; Boyle, M.; Lewis, M.J.; Pankhurst, J.; Wieneke, A.A.; Jacob, M. A large outbreak of food poisoning of unknown aetiology associated with Stilton cheese. Epidemiol. Infect. 1991, 106, 497–505. [Google Scholar] [CrossRef][Green Version]
- Osaili, T.M.; Hasan, F.; Al-Nabulsi, A.A.; Olaimat, A.N.; Ayyash, M.; Obaid, R.S.; Holley, R. A worldwide review of illness outbreaks involving mixed salads/dressings and factors influencing product safety and shelf life. Food Microbiol. 2023, 112, 104238. [Google Scholar] [CrossRef] [PubMed]
- Gould, L.H.; Mungai, E.; Behravesh, C.B. Outbreaks attributed to cheese: Differences between outbreaks caused by unpasteurized and pasteurized dairy products, United States, 1998–2011. Foodborne Pathog. Dis. 2014, 11, 545–551. [Google Scholar] [CrossRef] [PubMed]
- ICMSF. Microorganisms in Foods 6; Microbial Ecology of Food Commodities; Kluwer Academic & Plenum Publishers: New York, NY, USA, 2005; Volume 2. [Google Scholar]
- Bernini, V.; Bottari, B.; Dalzini, E.; Sgarbi, E.; Lazzi, C.; Neviani, E.; Gatti, M. The presence, genetic diversity and behaviour of Listeria monocytogenes in blue-veined cheese rinds during the shelf life. Food Control 2013, 34, 323–330. [Google Scholar] [CrossRef]
- Cocolin, L.; Nucera, D.; Alessandria, V.; Rantsiou, K.; Dolci, P.; Grassi, M.A.; Lomonaco, S.; Civera, T. Microbial ecology of Gorgonzola rinds and occurrence of different biotypes of Listeria monocytogenes. Int. J. Food Microbiol. 2009, 133, 200–205. [Google Scholar] [CrossRef]
- Gianfranceschi, M.; D’Ottavio, M.C.; Gattuso, A.; Pourshaban, M.; Bertoletti, I.; Bignazzi, R.; Manzoni, P.; Marchetti, M.; Aureli, P. Listeriosis associated with gorgonzola (Italian blue-veined cheese). Foodborne Pathog. Dis. 2006, 3, 190–195. [Google Scholar] [CrossRef]
- Health Protection Scotland. Incident Management Team Report: Outbreak of E. coli. 2017. Available online: http://www.hps.scot.nhs.uk (accessed on 25 April 2023).
- Schirone, M.; Visciano, P.; Conte, F.; Paparella, A. Formation of biogenic amines in the cheese production chain: Favouring and hindering factors. Int. Dairy J. 2022, 133, 105420. [Google Scholar] [CrossRef]
- Fröhlich-Wyder, M.T.; Arias-Roth, E.; Jakob, E. Cheese yeasts. Yeast 2019, 36, 129–141. [Google Scholar] [CrossRef]
- EFSA Euiropean Food Safety Authority. Panel on Biological Hazards (BIOHAZ) Scientific Opinion on risk-based control of biogenic amine formation in fermented foods. EFSA J. 2011, 9, 2393, 1–93. [Google Scholar] [CrossRef][Green Version]
- Lund, F.; Filtenborg, O.; Frisvad, J.C. Penicillium caseifulvum, a new species found on fermented Blue cheese. J. Food Mycol. 1998, 1, 95–101. [Google Scholar]
- Marcellino, N.; Benson, D.R. The good, the bad, and the ugly: Tales of mold-ripened cheese. Microbiol. Spectr. 2013, 1, 1–27. [Google Scholar] [CrossRef][Green Version]
- Seratlic, S.V.; Miloradovic, Z.N.; Radulovic, Z.T.; Macej, O.D. The effect of two types of mould inoculants on the microbiological composition, physicochemical properties and protein hydrolysis in two Gorgonzola-type cheese varieties during ripening. Int. J. Dairy Technol. 2011, 64, 408–416. [Google Scholar] [CrossRef]
- McSweeney, P.L.H. Biochemistry of cheese ripening. Int. J. Dairy Technol. 2004, 57, 127–144. [Google Scholar] [CrossRef]
- Zarmpoutis, I.V.; McSweeney, P.L.H.; Beechinor, J.; Fox, P.F. Proteolysis in the Irish farmhouse blue cheese, Chetwynd. Irish J. Agric. Food Res. 1996, 35, 25–36. [Google Scholar]
- Sousa, M.J.; Ardö, Y.; McSweeney, P.L.H. Advances in the study of proteolysis during cheese ripening. Int. Dairy J. 2001, 11, 327–345. [Google Scholar] [CrossRef]
- Eigel, W.; Butler, J.; Ernstrom, C.; Farrell, H.; Harwalkar, V.; Jenness, R.; Whitney, R.M. Nomenclature of proteins of cow’s milk: Fifth revision. J. Dairy Sci. 1984, 67, 1599–1631. [Google Scholar] [CrossRef]
- Gillot, G.; Jany, J.-L.; Poirier, E.; Maillard, M.; Debaets, S.; Thierry, A.; Coton, E.; Coton, M. Functional diversity within the Penicillium roqueforti species. Int. J. Food Microbiol. 2017, 241, 141–150. [Google Scholar] [CrossRef]
- Cakmakci, S.; Hayaloglu, A.A.; Dagdemir, E.; Gurses, M.; Cetin, B.; Tahmas-Kahyaoglu, D. Effects of Penicillium roqueforti and whey cheese on gross composition, microbiology and proteolysis of mould-ripened Civil cheese during ripening. Int. J. Dairy Technol. 2014, 66, 512–526. [Google Scholar] [CrossRef]
- Diezhandino, I.; Fernandez, D.; Combarros-Fuertes, P.; Renes, E.; Fresno, J.M.; Tornadijo, M.E. Characteristics and proteolysis of a Spanish blue cheese made with raw or pasteurised milk. Int. J. Dairy Technol. 2022, 75, 630–642. [Google Scholar] [CrossRef]
- Masotti, F.; Cattaneo, S.; Stuknytė, M.; Battelli, G.; Vallone, L.; De Noni, I. Composition, proteolysis, and volatile profile of Strachitunt cheese. J. Dairy Sci. 2017, 100, 1679–1687. [Google Scholar] [CrossRef][Green Version]
- Mane, A.; Ciocia, F.; Beck, T.K.; Lillevang, S.K.; McSweeney, P.H.L. Proteolysis in Danish blue cheese during ripening. Int. Dairy J. 2019, 97, 191–200. [Google Scholar] [CrossRef]
- Rafiq, S.; Gulzar, N.; Sameen, A.; Huma, N.; Hayati, I.; Ijaz, R. Functional role of bioactive peptides with special reference to cheeses. Int. J. Dairy Technol. 2021, 74, 1–257. [Google Scholar] [CrossRef]
- Sánchez-Rivera, L.; Diezhandino, I.; Gómez-Ruiz, J.A.; Fresno, J.M.; Miralles, B.; Recio, I. Peptidomic study of Spanish blue cheese (Valdeón) and changes after simulated gastrointestinal digestion. Electrophoresis 2014, 35, 1627–1636. [Google Scholar] [CrossRef] [PubMed]
- Flórez, A.B.; Ruas-Madiedo, P.; Alonso, L.; Mayo, B. Microbial, chemical and sensorial variables of the Spanish traditional blue-veined Cabrales cheese, as affected by inoculation with commercial Penicillium roqueforti spores. Eur. Food Res. Technol. 2006, 222, 250–257. [Google Scholar] [CrossRef]
- Prieto, B.; Franco, I.; Fresno, J.M.; Bernardo, A.; Carballo, J. Picón Bejes-Tresviso blue cheese: An overall biochemical survey throughout the ripening process. Int. Dairy J. 2000, 10, 159–167. [Google Scholar] [CrossRef]
- Redruello, B.; Szwengiel, A.; Ladero, V.; del Rio, B.; Alvarez, M.A. Identification of technological/metabolic/environmental profiles of cheeses with high GABA contents. LWT—Food Sci. Technol. 2020, 130, 109603. [Google Scholar] [CrossRef]
- Santiago-López, L.; Aguilar-Toalá, J.E.; Hernández-Mendoza, A.; Vallejo-Cordoba, B.; Liceaga, A.M.; González-Córdova, A.F. Invited review: Bioactive compounds produced during cheese ripening and health effects associated with aged cheese consumption. J. Dairy Sci. 2018, 101, 3742–3757. [Google Scholar] [CrossRef][Green Version]
- Reinholds, I.; Rusko, J.; Pugajeva, I.; Berzina, Z.; Jansons, M.; Kirilina-Gutmane, O.; Tihomirova, K.; Bartkevics, V. The occurrence and dietary exposure assessment of mycotoxins, biogenic amines, and heavy metals in mould-ripened blue cheeses. Foods 2020, 9, 93. [Google Scholar] [CrossRef][Green Version]
- Duval, P.; Chatelard-Chauvin, C.; Gayard, G.; Rifa, E.; Bouchard, P.; Hulin, S.; Delile, A.; Pollet, B.; Montel, M.C.; Picque, D. Changes in biochemical and sensory parameters in industrial blue-veined cheeses in different packaging. Int. Dairy J. 2018, 77, 87–99. [Google Scholar] [CrossRef]
- Diezhandino, I.; Fernández, D.; Abarquero, D.; Prieto, B.; Renes, E.; Fresno, J.M.; Tornadijo, M.E. Cambios en la concentración y perfil de ácidos grasos libres durante la maduración de un queso español de venas azules elaborado con leche cruda y pasteurizada de vaca y cabra. Productos lácteos 2023, 4, 222–234. [Google Académico] [CrossRef]
- Collins, Y.F.; McSweeney, P.L.H.; Wilkinson, M.G. Lipólisis y catabolismo de ácidos grasos libres en el queso: una revisión del conocimiento actual. Int. Lácteos J. 2003, 13, 841–866. [Google Académico] [CrossRef]
- Gallois, A.; Langlois, D. Nuevos resultados en los compuestos olorosos volátiles de los quesos franceses. Lait 1990, 70, 89–106. [Google Académico] [Referencia cruzada] [Versión Verde]
- Moio, L.; Piombino, P.; Addeo, F. Compuestos que afectan a los olores del queso Gorgonzola. J. Dairy Res. 2000, 67, 273–285. [Google Académico] [Referencia cruzada] [PubMed]
- Gkatzionis, K.; Linforth, R.S.; Dodd, C.E. Perfil volátil de los quesos Stilton: Diferencias entre las zonas dentro de un queso y las queserías. Químico de los alimentos. 2009, 113, 506–512. [Google Académico] [CrossRef]
- Torri, L.; Aprea, E.; Piochi, M.; Cabrino, G.; Endrizzi, I.; Colaianni, A.; Gasperi, F. Relación entre los atributos sensoriales, el (des)gusto y la composición orgánica volátil del queso Gorgonzola DOP. Alimentos 2021, 10, 2791. [Google Académico] [Referencia cruzada] [PubMed]
- Hayaloglu, A.A.; Brechany, E.Y.; Deegan, K.C.; McSweeney, P.L.H. Caracterización de la química, bioquímica y perfil volátil del queso Kuflu, una variedad madurada con moho. LWT—Tecnología de Ciencias de los Alimentos. 2008, 41, 1323-1334. [Google Académico] [CrossRef].
Fuente: López-Díaz, T.M.; Alegría, Á.; Rodríguez-Calleja, J.M.; Combarros-Fuertes, P.; Fresno, J.M.; Santos, J.A.; Flórez, A.B.; Mayo, B.
Blue Cheeses: Microbiology and Its Role in the Sensory Characteristics.
Dairy 2023, 4, 410–422. https://doi.org/10.3390/dairy4030027














