Vico Ana Paula1, *; Diaz Vergara Ladislao Iván1; Ribotta Pablo Daniel2 y Montenegro Mariana Angélica1.
1Instituto Multidisciplinario de Investigación y Transferencia Agroalimentaria y Biotecnológica – Universidad Nacional de Villa María. Villa María, Córdoba, Argentina. https://imitab.conicet.gov.ar/
2Instituto de Ciencia y Tecnología de los Alimentos Córdoba – Universidad Nacional de Córdoba. Córdoba, Argentina. https://www.icytac.conicet.unc.edu.ar/ *anavico@unvm.edu.ar
Resumen
Las proteínas del suero son un co-producto de la producción láctea con excelentes propiedades nutricionales, biológicas y tecnológicas, lo que las convierte en un foco de interés para su implementación en la industria alimentaria. La hidrólisis enzimática es una estrategia que modifica la funcionalidad de las proteínas del suero. Diferentes procesos previos y posteriores a la hidrólisis pueden influir en la funcionalidad final de las proteínas, siendo el secado uno de las más relevantes. El objetivo de este trabajo fue evaluar las características de un hidrolizado de proteína de suero en polvo obtenido mediante secado por liofilización y aspersión. Para ello, el hidrolizado de proteína de suero (WPH) fue producido a partir de aislado de proteína de suero (WPI) con quimotripsina y posteriormente secado por aspersión y por liofilización, obteniéndose los productos WPHS y WPHL, respectivamente. En ambos polvos se evaluó la composición química, el grado de hidrólisis, el perfil electroforético, el color, las propiedades emulsificantes y espumantes y la capacidad antioxidante in vitro. Esta última se evaluó mediante las técnicas de desactivación del radical catión ABTS•+, poder reductor del ion férrico (FRAP), quelación de metales y desactivación de los radicales anión superóxido (O2•−) e hidroxilo (HO•). También se evaluó el rendimiento de cada proceso. No se encontraron diferencias estadísticamente significativas entre la composición, el grado de hidrólisis y el perfil electroforético de WPHS y WPHL. Así como tampoco para el índice de pardeamiento, la capacidad de formación y estabilidad de espuma y el índice de estabilidad de emulsión. No obstante, WPHL presentó un índice de actividad de emulsión superior a WPHS. Con respecto a la capacidad antioxidante, WPHL presentó valores estadísticamente significativos iguales para ABTS•+, superiores para FRAP y desactivar O2•−, e inferiores para quelar metales y desactivar HO• respecto a WPHS. Los resultados demuestran que tanto el secado por aspersión como por liofilización pueden emplearse para obtener hidrolizados de proteínas de suero en polvo con elevada capacidad antioxidante e interesantes propiedades tecnológicas. También se resalta el mayor índice de actividad de emulsión y rendimiento obtenidos con la tecnología de liofilización. Por lo tanto, la decisión final del método a utilizar se basará en una relación de compromiso entre los costos, la disponibilidad de equipamiento y las características finales deseadas del polvo. Con respecto a esto último, resulta relevante no sólo considerar las propiedades bioactivas sino también las tecnológicas cuando se trata de nuevos ingredientes alimenticios.
Introducción
El suero lácteo es un abundante subproducto de la industria láctea que contiene en su composición proteínas de alto valor biológico y tecnológico, como β-lactoglobulina (β-Lg), α-lactoalbúmina (α-La), albúmina de suero bovino (BSA), lactoferrina, lactoperoxidasa, glicomacropéptido (GMP) e inmunoglobulinas. Por ello, diferentes productos comerciales son fabricados mediante la concentración de las proteínas del suero para obtener concentrados (WPC) y/o aislados (WPI) proteicos (Corrochano y col., 2018).
La producción de hidrolizados proteicos mediante la aplicación de enzimas es una estrategia ampliamente estudiada en los últimos años. El producto final de la hidrólisis enzimática es un conjunto de péptidos y aminoácidos libres cuyas características no sólo depende del tipo de sustrato y la especificidad de la enzima, sino también de la aplicación de pretratamiento, las condiciones de reacción y los tratamientos posteriores (Dullius y col., 2018). Estos factores influyen en las propiedades biológicas y tecnológicas de los productos resultantes. Por lo tanto, resulta interesante evaluar estas propiedades de los nuevos ingredientes alimenticios desarrollados dado que, además de los aportes a nivel fisiológico, pueden afectar las propiedades fisicoquímicas y tecnológicas del alimento. Actualmente, múltiples estudios ya han establecido que la hidrólisis enzimática modifica la funcionalidad de las proteínas nativas (Ballatore y col., 2020; Corrochano y col., 2019; Kheroufi y col., 2022; Vico y col., 2023a; Vico y col., 2023b)
Por otro lado, el secado es un proceso primordial para transformar los productos líquidos en polvos más estables, siendo la liofilización y el secado por aspersión los más comúnmente utilizados en laboratorios e industrias (Kleekayai y col., 2022). Es por ello, que el objetivo de este trabajo fue evaluar las características de un hidrolizado producido a partir de aislado de proteína de suero con quimotripsina secado por dos procesos diferentes: liofilización y aspersión.
Materiales y métodos
Materiales
Se utilizó un aislado de proteína de suero (WPI) con un contenido de proteína de 86,40 ± 0,17% p/p (base húmeda) gentilmente donado por Arla Foods Ingredients. La hidrólisis fue realizada con α-quimotripsina de páncreas bovino (≥40 U/mg) obtenida de Sigma-Aldrich.
Hidrólisis enzimática de WPI con quimotripsina
La hidrólisis de WPI con quimotripsina se llevó a cabo bajo condiciones previamente optimizadas (Vico y col., 2023b). Las cuales son una temperatura de 46,5°C, tiempo de 3 h, relación enzima/sustrato de 0,017 y concentración inicial de sustrato de 8% p/v de proteína. El sustrato para la hidrólisis se preparó el día anterior, para ello la cantidad correspondiente de WPI se disolvió en buffer fosfato 0,1 M (pH 8). Una vez finalizado el tiempo de hidrólisis, la enzima se inactivó a 80°C por 20 min y los hidrolizados resultantes se enfriaron en baño de hielo.
Obtención de los hidrolizados en polvo
El hidrolizado final se secó por liofilización (WPHL) y por aspersión (WPHS). WPHL se obtuvo luego de 48 h de tratamiento a un vacío final de 20 micrones de Hg y 25°C en un liofilizador RIFICOR L-I-E300-CRT (Imagen 1), con previa congelación a -80°C. WPHS se obtuvo con un Mini Spray Dryer BUCHI B290 (Imagen 2), cuyas condiciones fueron temperatura de entrada y de salida 120°C y 68°C, caudal de alimentación 6 mL/min, aspiración 35 m3/h y velocidad de aire 600 L/h. Se calculó el rendimiento (R) de cada proceso de secado según la ecuación 1.
R (%)= 〖MS〗_D/〖MS〗_A x100 (1)
Donde MSA y MSD son las masas de sólidos antes y después del secado.

Imagen 1 – Liofilizador RIFICOR L-I-E300-CRT
Composición química y grado de hidrólisis
El contenido de proteína se evaluó por el método de Kjeldahl. La humedad se determinó por método de referencia en estufa a 105°C hasta peso constante. Para el contenido de ceniza la muestra se calcinó y luego se sometió 4 h a 550°C en mufla. Se cuantificaron las azúcares totales por el método de Fenol-Sulfúrico. El grado de hidrólisis (GH) se determinó mediante el método del ortoftaldehído (Nielsen y col., 2001).
Perfil proteico por electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (SDS-PAGE)
Se analizó el perfil proteico de los hidrolizados mediante glicina electroforesis en gel de poliacrilamida con dodecilsulfato de sodio (Glicina-SDS-PAGE) según Laemmli (1970) con modificaciones según se describe en Ballatore y col. (2020). Junto con las muestras de WPHL y WPHS se corrieron un marcador de peso molecular (MW) de entre 116-14,4 KDa, WPI y los patrones de las proteínas séricas BSA y β-Lg.
Propiedades tecno-funcionales
La determinación del color se basó en el espacio de color CIELab compuesto por las tres coordenadas colorimétricas L, a y b* utilizando un colorímetro (Konica Minoltta CR-400). A partir de las coordenadas CIELab obtenidas, se calculó el índice de pardeamiento (IP) utilizando las ecuaciones 2 y 3 (Badin y col., 2020).
IP= (100(X-0,31))/(0,17) (2)
X=((a^+1,75L^))/(5,645L^+a^-3,012b^*)) (3)
Las propiedades emulsificantes se evaluaron mediante el índice de actividad de emulsión (EAI) y el índice de estabilidad de emulsión (ESI), cuantificados mediante las ecuaciones 4 y 5, respectivamente, (Shi y col., 2020). Las emulsiones se prepararon mezclando 30 mL de una dispersión de proteína al 0,05% p/v (pH=7) con 10 mL de aceite de soja mediante homogeneización a 10000 rpm por 2 min. Se tomaron 10 µL del fondo de la emulsión homogeneizada, se agregaron a 5 mL de una solución de SDS al 0,1% p/v y se leyó la absorbancia a 500 nm. El mismo procedimiento se repitió a los 10 min.
EAI (m^2⁄g)=(2×2,303xA_0 xDF)/Cx(1-θ)xlx10000 (4)
ESI(%)=A_10/A_0 x100 (5)
Donde DF es el factor de dilución (500), C es la concentración de proteínas en g/cm3, θ es la fracción del volumen de aceite (1/4), l es el paso óptico (1 cm), A0 y A10 son las absorbancias a 500 nm correspondientes a los 0 y 10 min.
Las propiedades espumantes se evaluaron mediante la capacidad de formación de espuma (CE) y la estabilidad de la espuma (EE) empleando las ecuaciones 6 y 7, respectivamente, (Shi y col., 2020). Para ello, 20 mL (V0) de una solución de proteína al 1% p/v se homogeneizó a 10.000 rpm por 2 min, y el volumen de espuma obtenido fue registrado (V1). Luego de 30 min, el volumen de la espuma fue nuevamente registrado (V2).
CE (%)= (V_1-V_0)/V_0 x100 (6)
EE(%)= (V_2-V_0)/(V_1-V_0 ) x100 (7)

Imagen 2 – Mini Spray Dryer BUCHI B290.
Capacidad antioxidante
La capacidad antioxidante se determinó por ABTS•+ según Re y col. (1999) con adecuaciones según Ballatore y col. (2020) y se expresó como la concentración de proteína (mg/mL) necesaria para inhibir el 50% del radical (CI50). El poder reductor del ion férrico (FRAP) se determinó según Benzie y Strain (1996) con modificaciones para proteínas de suero según Corrochano y col. (2019) y se expresó como equivalente en trolox (TEAC) en µmol trolox/g proteína. Para la determinación de la desactivación del radical anión superóxido (O2•-) y del radical hidroxilo (HO•) se empleó el método de autooxidación del pirogalol a pH = 7,4 (Li, 2012) y el método de la desoxirribosa (Vanden Braber y col., 2018), respectivamente. La capacidad quelante del hierro (II) se determinó por el método de la ferrozina según Decker & Welch (1990) con modificaciones. Estos últimos se expresaron como CI50.
Análisis estadístico
Todos los experimentos se realizaron por triplicado y los datos se presentan como la media ± desviación estándar. Los resultados se compararon mediante ANOVA y prueba de Tukey utilizando InfoStat 2014/e (Grupo InfoStat, Universidad Nacional de Córdoba, Argentina).
Resultados y discusión
En el proceso de liofilización se obtuvo un rendimiento del 93%, mientras que en el del secado por aspersión un rendimiento del 74%. Sin embargo, el valor del rendimiento del secado por aspersión puede ser optimizado modificando distintos parámetros como las condiciones de secado, la concentración de sólidos iniciales, ciclones de alta eficiencia, etc., lo cual no ha sido el objeto de este trabajo.
El proceso de secado no influyó en el GH (WPHL = 12,7 ± 0,4% y WPHS = 12,9 ± 0,0%) así como tampoco en el contenido de proteínas y humedad, dado que no se observan diferencias significativas (Tabla 1). Sin embargo, es importante resaltar que los parámetros de las condiciones de secado pueden influir en las características finales de los polvos (Kleekayai y col., 2022).
Tabla 1 – Composición porcentual (% p/p) de WPHL y WPHS en base húmeda.
Componente WPHL WPHS
Proteína 82,88 ± 0,26a 82,76 ± 0,24a
Humedad 5,40 ± 0,08a 5,57 ± 0,03a
Cenizas 9,64 ± 0,04a 9,28 ± 0,11b
Azúcares 0,75 ± 0,01a 0,79 ± 0,02a
Medias con letras diferentes en la misma fila poseen diferencia significativa (p<0,05).
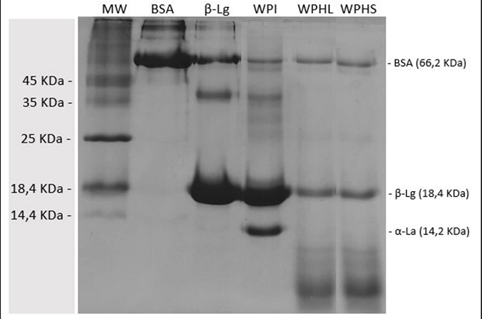
En el perfil electroforético obtenido mediante Glicina-SDS-PAGE (Imagen 3) no se observa diferencia entre WPHL y WPHS. Esto demuestra que los procesos de secado no afectaron el perfil proteico, lo cual está en concordancia con el análisis de los GH obtenidos.
El color de WPHL y WPHS se evaluó para determinar el efecto del proceso de secado sobre la apariencia física de los polvos y su posterior repercusión en las características sensoriales. No obstante, no se encontraron diferencias significativas entre los valores de IP de WPHL y WPHS (Tabla 2). Kleekayai y col. (2022) no encontraron evidencias de formación de productos de reacción de Maillard que puedan contribuir al pardeamiento del hidrolizado secado por aspersión.
Tabla 2 – Propiedades tecno-funcionales de WPHL y WPHS.
Muestra IP EAI (m2/g) ESI (%) CE (%) EE (%)
WPHL 1,90 ± 0,23a 316 ± 3a 84 ± 3a 247 ± 6a 86 ± 5a
WPHS 2,07 ± 0,06a 279 ± 13b 88 ± 7a 245 ± 5a 93 ± 1a
Medias con letras diferentes en la misma columna poseen diferencia significativa (p<0,05).
Con respecto a las propiedades emulsificantes y espumante (Tabla 2), el proceso de secado solamente influyó en el EAI, siendo la liofilización la tecnología más adecuada. Esto podría deberse a un efecto sobre la hidrofobicidad superficial de las proteínas, dado que no se observó diferencia en el GH entre WPHL y WPHS, como se mencionó anteriormente. Chen y col., (2012) reportaron que el secado por aspersión tuvo un impacto perjudicial significativo sobre las propiedades emulsificantes y espumantes de hidrolizados de clara de huevo con papaína respecto a la liofilización. Por otro lado, Gong y col., (2016) encontraron que tanto los EAI y ESI como la estructura de aislados de proteína de maní preparados por secado por aspersión y liofilización eran significativamente diferentes. Estos autores concluyeron que ambos métodos de secado pueden usarse para producir polvos de aislado de proteína de maní con estructura y propiedades emulsificantes diferentes.
La capacidad antioxidante de WPHS no mostró diferencia estadísticamente significativa para ABTS•+, fue significativamente menor para FRAP y O2•-, y significativamente mayor para HO• y quelación de metales respecto a WPHL (Tabla 3). Por lo que se podría decir que la capacidad antioxidante fue influenciada por el proceso de secado, pero sin mayor impacto. Lo cual se encuentra en concordancia con estudios previos. Kleekayai y col. (2022) reportaron que el efecto del proceso de secado se reflejó en diferencias significativas o no sobre valores de TEAC y ORAC de hidrolizados de un concentrado de proteína de suero (WPC 80) con Alcalase® y Prolyve® bajo distintas condiciones de pH. Mientras Chen y col., (2012) reportaron que el proceso de secado no influyó significativamente sobre la actividad antioxidante (DPPH, poder reductor y peroxidación lipídica) de hidrolizados de clara de huevo con papaína.
Tabla 3 – Perfil de capacidad antioxidante de WPHL y WPHS.
Muestra ABTS•+
CI501 FRAP
TEAC2 O2•-
CI501 OH•
CI501 Quelación Fe(II) CI501
WPHL 0,0235 ± 0,0003a 20,8 ± 0,2a 1,01 ± 0,01b 0,88 ± 0,05a 0,63 ± 0,01a
WPHS 0,0247 ± 0,0006a 19,6 ± 0,2b 1,53 ± 0,01a 0,74 ± 0,02b 0,61 ± 0,01b
Medias con letras diferentes en la misma columna poseen diferencia significativa (p<0,05). 1mg proteína/mL, 2µmol trolox/g proteína.
Conclusiones
Dado que el secado es uno de los pasos más costosos y que consume más energía en los procesos industriales y que el secado por aspersión se usa comúnmente para fabricar alimentos y productos lácteos en polvo a escala industrial, es que resultó relevante evaluarlo como un posible método de secado y compararlo con la liofilización.
Los resultados demuestran que tanto el secado por aspersión como por liofilización pueden ser aprovechados para obtener hidrolizados de proteínas de suero en polvo con elevada capacidad antioxidante e interesantes propiedades tecnológicas. En donde las principales diferencias se destacan en un el mayor índice de actividad de emulsión y rendimiento obtenidos con la tecnología de liofilización.
Aunque la decisión final se basará en una relación de compromiso entre los costos, disponibilidad de equipamiento y las características finales del producto, este trabajo sienta los precedentes para que ambos procesos de secado puedan emplearse y no limita a la industria a un solo tipo de tecnología.
Agradecimientos
Los autores agradecen el apoyo financiero de CONICET, Agencia Nacional de Promoción de la Investigación, el Desarrollo Tecnológico y la Innovación y Universidad Nacional Villa María.
Bibliografía
Badin, E. E., Rossi, Y. E., Montenegro, M. A., Ibarz, A., Ribotta, P. D., & Lespinard, A. R. (2020). Thermal processing of raspberry pulp: Effect on the color and bioactive compounds. Food and Bioproducts Processing, 124, 469-477.
Ballatore, M. B., Bettiol, M. del R., Vanden Braber, N. L., Aminahuel, C. A., Rossi, Y. E., Petroselli, G., Erra-Balsells, R., Cavaglieri, L. R., & Montenegro, M. A. (2020). Antioxidant and cytoprotective effect of peptides produced by hydrolysis of whey protein concentrate with trypsin. Food Chemistry, 319, 126472.
Benzie, I. F. F., & Strain, J. J. (1996). The ferric reducing ability of plasma (FRAP) as a measure of «antioxidant power»: The FRAP assay. Analytical Biochemistry, 239(1), 70-76.
Chen, C., Chi, Y. J., & Xu, W. (2012). Comparisons on the Functional Properties and Antioxidant Activity of Spray-Dried and Freeze-Dried Egg White Protein Hydrolysate. Food and Bioprocess Technology, 5(6), 2342-2352.
Corrochano, A. R., Buckin, V., Kelly, P. M., & Giblin, L. (2018). Invited review: Whey proteins as antioxidants and promoters of cellular antioxidant pathways. Jour. of Dairy Science, 101(6), 4747-4761.
Corrochano, A. R., Sariçay, Y., Arranz, E., Kelly, P. M., Buckin, V., & Giblin, L. (2019). Comparison of antioxidant activities of bovine whey proteins before and after simulated gastrointestinal digestion. Journal of Dairy Science, 102(1), 54-67.
Dullius, A., Goettert, M. I., & de Souza, C. F. V. (2018a). Whey protein hydrolysates as a source of bioactive peptides for functional foods – Biotechnological facilitation of industrial scale-up. Journal of Functional Foods, 42, 58-74.
Decker, E. A., & Welch, B. (1990). Role of Ferritin as a Lipid Oxidation Catalyst in Muscle Food†. Journal of Agricultural and Food Chemistry, 38(3), 674-677.
Gong, K. J., Shi, A. M., Liu, H. Z., Liu, L., Hu, H., Adhikari, B., & Wang, Q. (2016). Emulsifying properties and structure changes of spray and freeze-dried peanut protein isolate. Journal of Food Engineering, 170, 33-40.
Kheroufi, A., Brassesco, M. E., Campos, D. A., Boughellout, H., & Pintado, M. E. (2022). Functional properties of peptides obtained from whey proteins by ficin extract hydrolysis. Food Bioscience, 1-10.
Kleekayai, T., O’neill, A., Clarke, S., Holmes, N., O’sullivan, B., & Fitzgerald, R. J. (2022). Contribution of Hydrolysis and Drying Conditions to Whey Protein Hydrolysate Characteristics and In Vitro Antioxidative Properties. Antioxidants, 11(2).
Laemmli, U. K. (1970). Cleavage of Structural Proteins during the Assembly of the Head of Bacteriophage T4. Nature, 227(5259), 680–685.
Li, X. (2012). Improved pyrogallol autoxidation method: A reliable and cheap superoxide-scavenging assay suitable for all antioxidants. Journal of Agricultural and Food Chemistry, 60(25), 6418-6424.
Nielsen, P. M., Petersen, D., & Dambmann, C. (2001). Improved method for determining food protein degree of hydrolysis. Journal of Food Science, 66(5), 642-646.
Re, R., Pellegrini, N., Proteggente, A., Pannala, A., Yang, M., & Rice-Evans, C. (1999). Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radical Biology and Medicine, 26(9-10), 1231-1237.
Shi, R., Liu, Y., Hu, J., Gao, H., Qayum, A., Bilawal, A., Munkh-Amgalan, G., Jiang, Z., & Hou, J. (2020). Combination of high-pressure homogenization and ultrasound improves physiochemical, interfacial and gelation properties of whey protein isolate. Innovative Food Science and Emerging Technologies, 102450.
Vanden, N. L., Paredes, A. J., Rossi, Y. E., Porporatto, C., Allemandi, D. A., Borsarelli, C. D., Correa, S. G., & Montenegro, M. A. (2018). International Journal of Biological Macromolecules Controlled release and antioxidant activity of chitosan or its glucosamine water-soluble derivative microcapsules loaded with quercetin. International Journal of Biological Macromolecules, 112, 399404.
Vico, A.P., Centomo, A.M., Rossi, Y.E., Ribotta, P.D. y Montenegro, M.A. (2023a). Caracterización fisicoquímica y biológica de hidrolizados de proteína de suero lácteo con diferentes proteasas comerciales. III Jornada nacional de agroalimentos y sustentabilidad 2023. Universidad Nacional de Villa María, Villa María, Córdoba.
Vico, A.P., Aminahuel, C.A., Ribotta, P.D. y Montenegro, M.A. (2023b). Optimización del proceso de hidrólisis de proteína aislada de suero lácteo para la obtención de ingredientes alimentarios. Estudio de metodología de superficie de respuesta. Tecnología láctea latinoamericana, 124.

















